Tumor mediastinal gigante de células germinales. Un reto en el manejo quirúrgico
García-Vega, Luis Jesús1; Gutiérrez-Rentería, Juan Pablo1; García-González, Raymundo1; García-Carrazco, César Francisco1; Aguilar-Soto, Daniel Enrique1
García-Vega, Luis Jesús1; Gutiérrez-Rentería, Juan Pablo1; García-González, Raymundo1; García-Carrazco, César Francisco1; Aguilar-Soto, Daniel Enrique1
RESUMEN
Los tumores de células germinales del mediastino son un grupo heterogéneo de neoplasias benignas y malignas con una histología idéntica a algunas neoplasias de testículo y ovario. Sólo un pequeño porcentaje de los tumores primarios de células germinales surge en el mediastino, pero este sitio representa la mayoría de todos los tumores extragonadales de células germinales. Los hombres tienen muchas más probabilidades de tener este tipo de tumores que las mujeres. El examen físico cuidadoso y la ecografía de los testículos son medidas de rutina para excluir un tumor gonadal de células germinales. Los tumores de células germinales suelen ser asintomáticos y pueden identificarse de manera incidental como masas mediastínicas en las radiografías de tórax. Cuando hay síntomas, suelen ser el resultado de la compresión del árbol traqueobronquial. Presentamos el caso de un niño de 12 años con un tumor primario de células germinativas en mediastino, uno de los tumores más grandes reportados en la literatura médica, que representó un desafío para el equipo de cirujanos.PALABRAS CLAVE
Tumor de mediastino, tumor de células germinales, tumores mediastinales de células germinales.Introducción
Los tumores de células germinales se derivan de manera embriológica de células reproductoras y se originan principalmente en las gónadas. Sin embargo, en el 5% de los casos son de origen extragonadal.1 Su distribución anatómica varía ampliamente e incluye el mediastino, la región sacrococcígea, el cuello y el retroperitoneo.2 Los tumores de células germinales se clasifican como extragonadales si no hay evidencia de un tumor primario en los testículos u ovarios, el sitio extragonadal más común se reporta en el mediastino. El tipo morfológico incluye teratoma maduro/inmaduro, seminoma, tumor del saco vitelino, carcinoma embrionario, coriocarcinoma y tumores mixtos de células germinales gonadales.3
La predicción del comportamiento en estos tumores puede resultar confusa porque se basa en una combinación de diversos factores que incluyen la edad del paciente, el subtipo histológico, el sitio anatómico y el estadío clínico.4 En la mayoría de los pacientes, los tumores no seminomatosos en mediastínicos no producen síntomas hasta que crecen de manera considerable y ocupan un gran espacio. Las presentaciones varían desde hallazgos accidentales en la radiografía de rutina hasta compromisos respiratorio y cardiovascular que son potencialmente mortales.5
Presentación del caso
Se trata de un varón de 12 años sin antecedentes crónico degenerativos. Inicia padecimiento tres meses antes de su ingreso a urgencias con disnea, ortopnea, edema facial, tos nocturna y un episodio de síncope, motivo de revisión médica. A la exploración física saturación de oxígeno de 85% con pulsioximetría, plétora facial, edema palpebral, cuello con ligera desviación traqueal hacia la izquierda, ingurgitación yugular grado II, sin adenopatías, tórax en tonel, disminución de los movimientos respiratorios y matidez a la percusión sobre el hemitórax derecho, los ruidos cardíacos con ligero desplazamiento a la izquierda, disminuidos en intensidad, además de uso de musculatura accesoria durante la respiración.
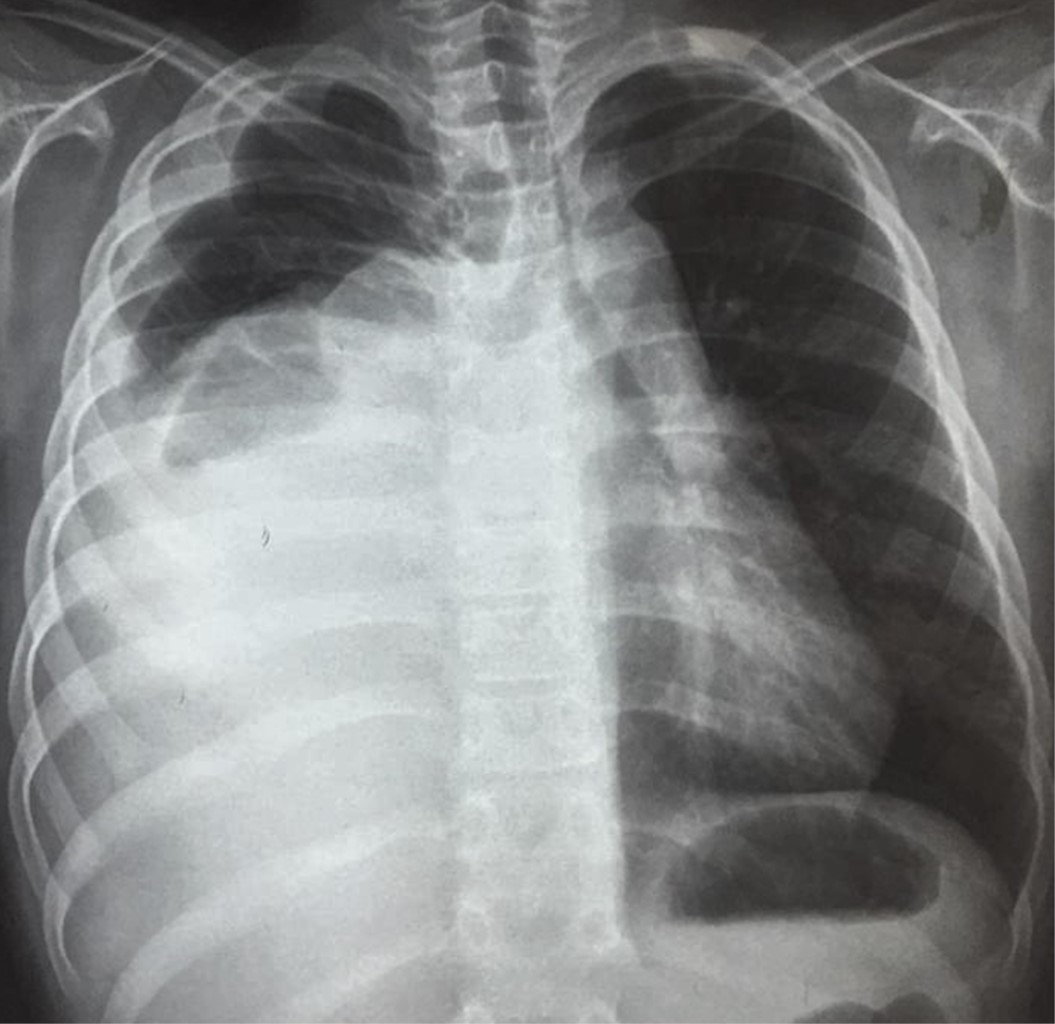
En la radiografía de tórax se observa hemitórax derecho una radiopacidad heterogénea que ocupa 60%, dos imágenes ovoideas en su ápice y ligero desplazamiento traqueal y mediastinal a la izquierda (Figura 1). La ecografía testicular fue normal.
Sus marcadores tumorales basales mostraron un nivel de alfafetoproteína de 5,550 mg/dL (valor normal: < 5 mg/dL), nivel de antígeno carcinoembrionario de 9.89 ng/mL (valor normal: < 5 ng/mL), subunidad β de la hormona gonadotropina coriónica humana de 67.6 mUI/mL (valor normal: < 2.5 mUI/mL) y nivel de lactato deshidrogenasa de 514 UI/L (valor normal: 140-333 UI/L). Se realizó biopsia guiada por ultrasonido, el resultado histopatológico reportó un teratoma inmaduro como primera sospecha diagnóstica.
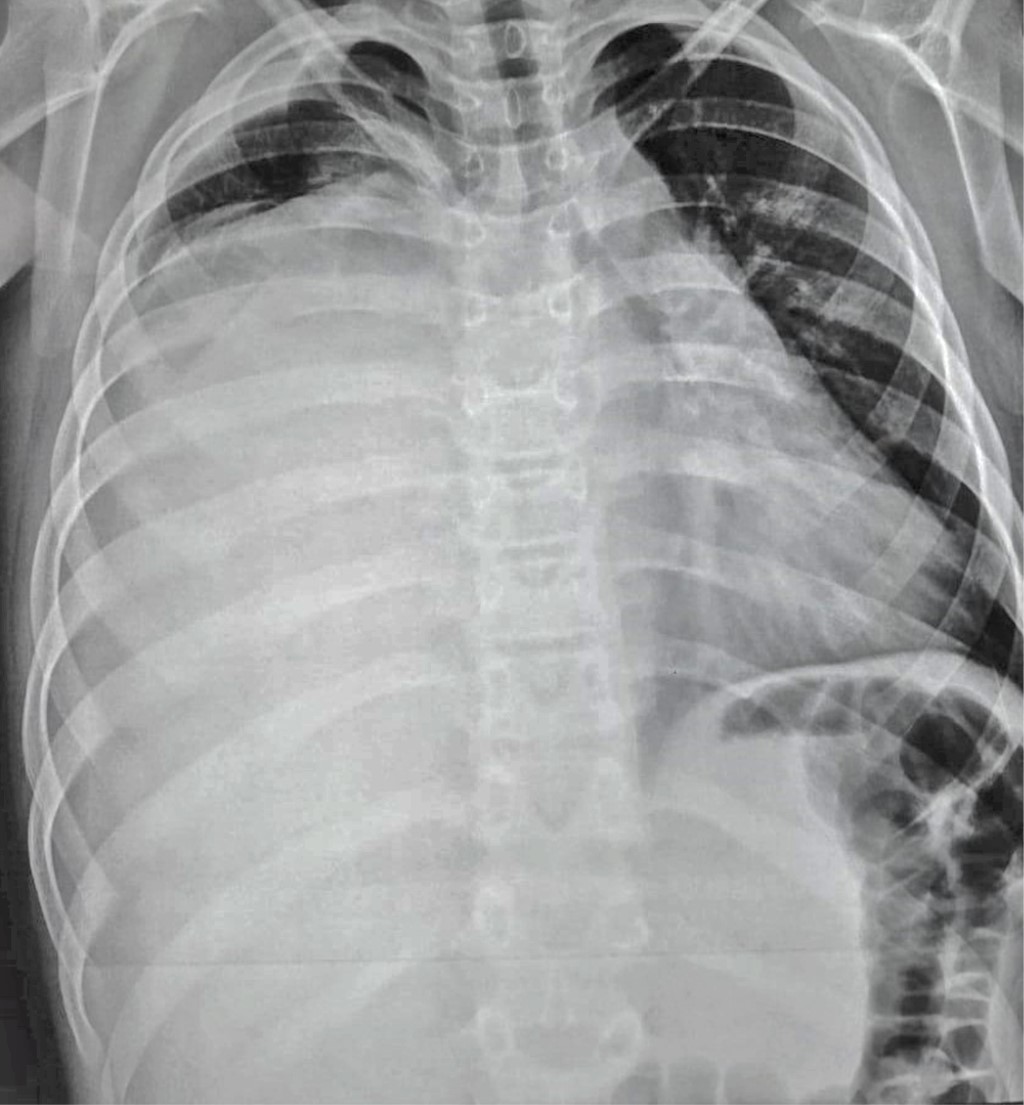
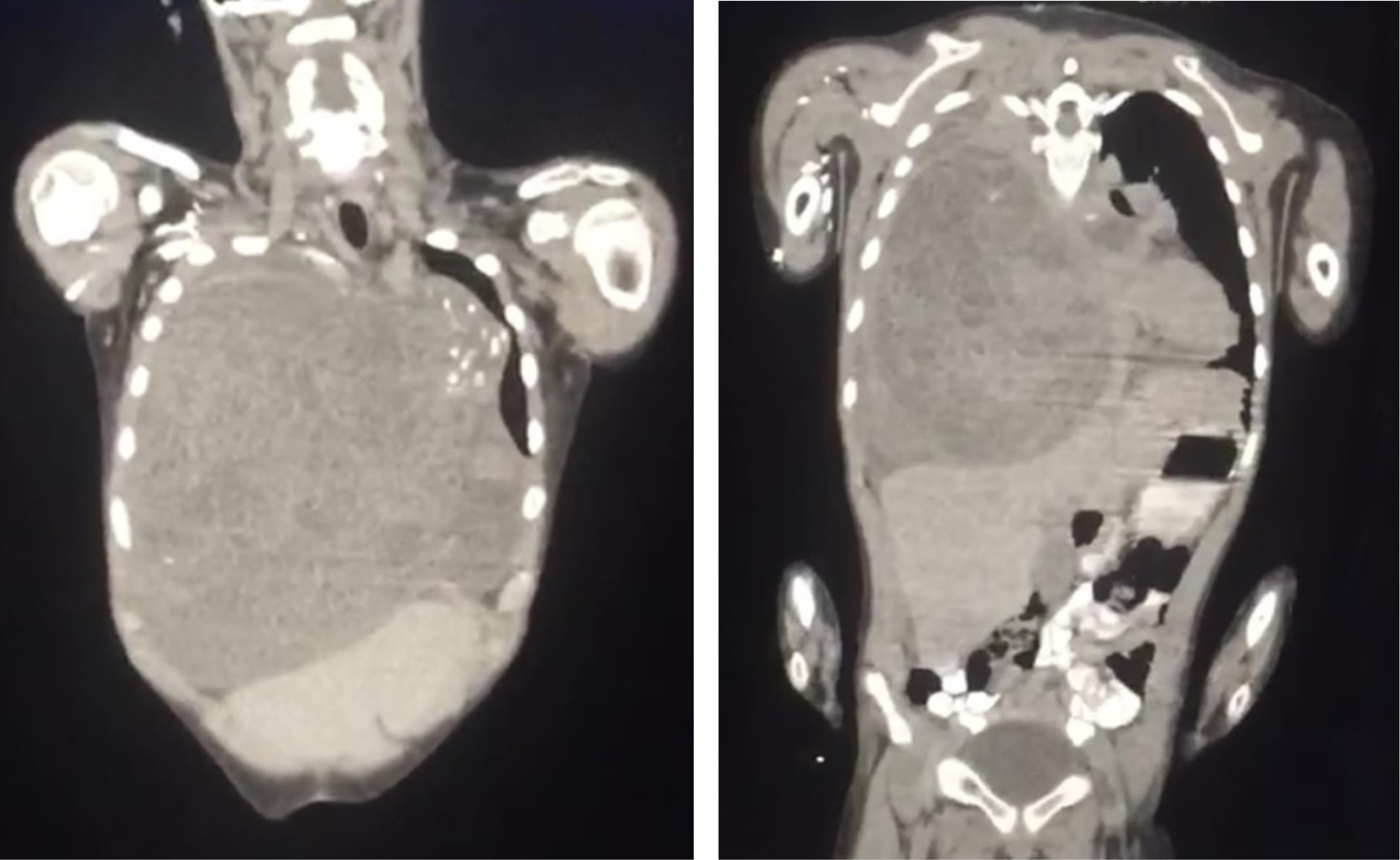
Se inicia esquema de tratamiento basado en tres ciclos de quimioterapia neoadyuvante estándar con bleomicina, etopósido y cisplatino. Los marcadores tumorales después de la quimioterapia mejoraron notablemente durante los primeros dos ciclos; sin embargo, el control radiográfico mostró un crecimiento tumoral que ocupa 80% del hemitórax derecho con aumento en el desplazamiento de las estructuras mediastinales (Figura 2). Se optó por continuar el tercer ciclo de quimioterapia, los marcadores tumorales permanecieron sin cambios, se decide realizar tomografía toracoabdominal como estudio de extensión para descartar metástasis. Lamentablemente, se evidencia un crecimiento exponencial del tumor que ocupaba 100% del hemitórax derecho y mediastino anterior sobrepasando más allá de la línea media del cuerpo con colapso del pulmón derecho, desplazamiento del corazón y grandes vasos hacia el lado izquierdo así como los componentes del mediastino posterior como tráquea y esófago, el abdomen sin evidencia de metástasis (Figura 3). Se realizó ecocardiograma transtorácico con datos de disfunción diastólica del ventrículo derecho con compresión de la aurícula derecha y vena cava inferior, hipertensión arterial pulmonar moderada, levocardia, levoapex, desplazamiento extremo del corazón a la línea axilar media, lo que implicaba empeoramiento clínico de nuestro paciente.
Se valoró por el servicio de cirugía cardiotorácica y oncología quirúrgica para establecer el mejor plan quirúrgico de rescate debido a las fallas terapéuticas, ya que no existía otro método terapéutico que pudiera reducir el tamaño tumoral, tras un consenso y un consentimiento informado explicando ampliamente los riesgos quirúrgicos y la alta mortalidad con o sin tratamiento quirúrgico. Sabiendo que por las grandes dimensiones del tumor en cualquier momento el paciente podría presentar colapso cardiopulmonar y muerte súbita, se decide llevar a cabo acto quirúrgico.
En sala de quirófano se contó con máquina de circulación extracorpórea en centinela pensando en compromiso de grandes vasos y cámaras cardíacas que requirieran resección e injertos vasculares así como equipo de recuperador celular. Se lleva a cabo el procedimiento quirúrgico tras monitoreo invasivo, colocación de acceso venoso vascular femoral. Se colocó al paciente en posición semifowler y lateralizado a la derecha debido al riesgo de compresión de estructuras cardíacas durante la inducción anestésica; sin embargo, tras la relajación muscular de la anestesia general el paciente presentó parada cardíaca, se procedió a una esternotomía media inmediata con tracción para liberar la tensión del tumor sobre las estructuras cardiovasculares, luego de esta maniobra mostró latidos cardíacos espontáneos, se extiende la incisión hacia epigastrio y a nivel del sexto espacio intercostal derecho hasta línea axilar para una mejor exposición. Se utiliza grapadora quirúrgica lineal y equipo de hemostasia por termocoagulación para disecar la tumoración del parénquima pulmonar, el cual se encontraba colapsado y con presencia de múltiples adherencias firmes y laxas al tumor y de septos interlobulares. Por fortuna, se logró preservar el pulmón por completo, se continúa la disección de grandes vasos para posteriormente lograr extraer el tumor, se reparan disrupciones pulmonares con sutura de absorción lenta, se realizan maniobras de Valsalva para corroborar ausencia de fugas. Por último, se coloca drenaje endopleural derecho y se cierra cavidad por planos anatómicos.
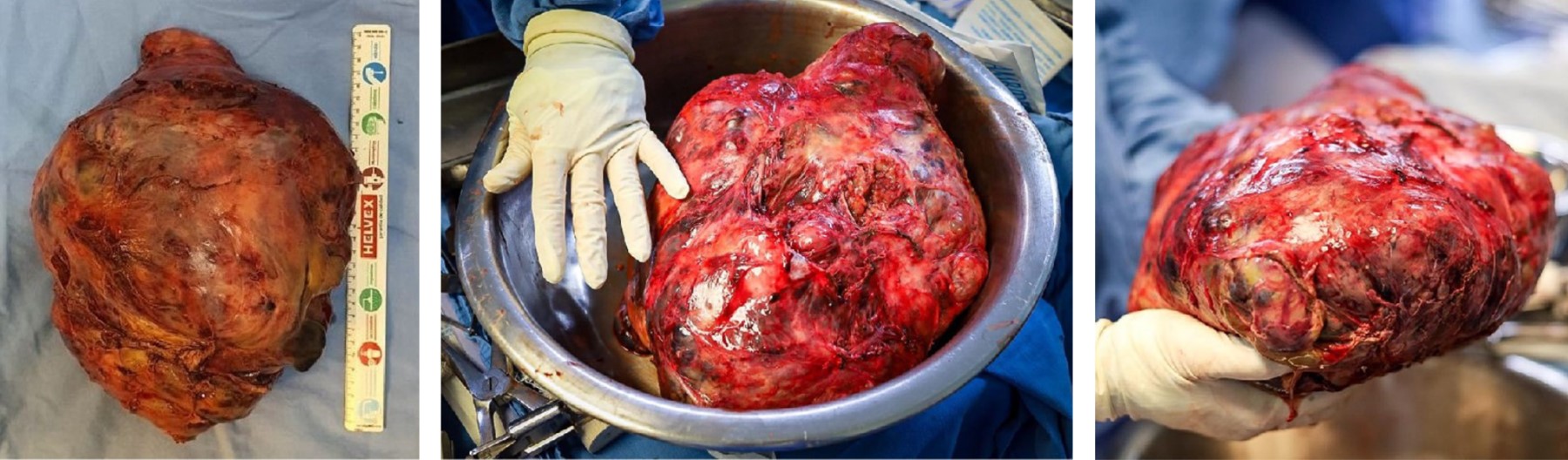
Los hallazgos quirúrgicos fueron: un tamaño tumoral de 30 × 23 × 15 cm ubicado en mediastino anterior, forma ovoide, superficie lisa y blanda, peso de 5 kg (Figura 4), que ocupa casi todo el hemitórax derecho con colapso pulmonar completo, la región superior del hemitórax izquierdo con desplazamiento extremo del corazón y grandes vasos, con compresión casi total de vena cava superior.
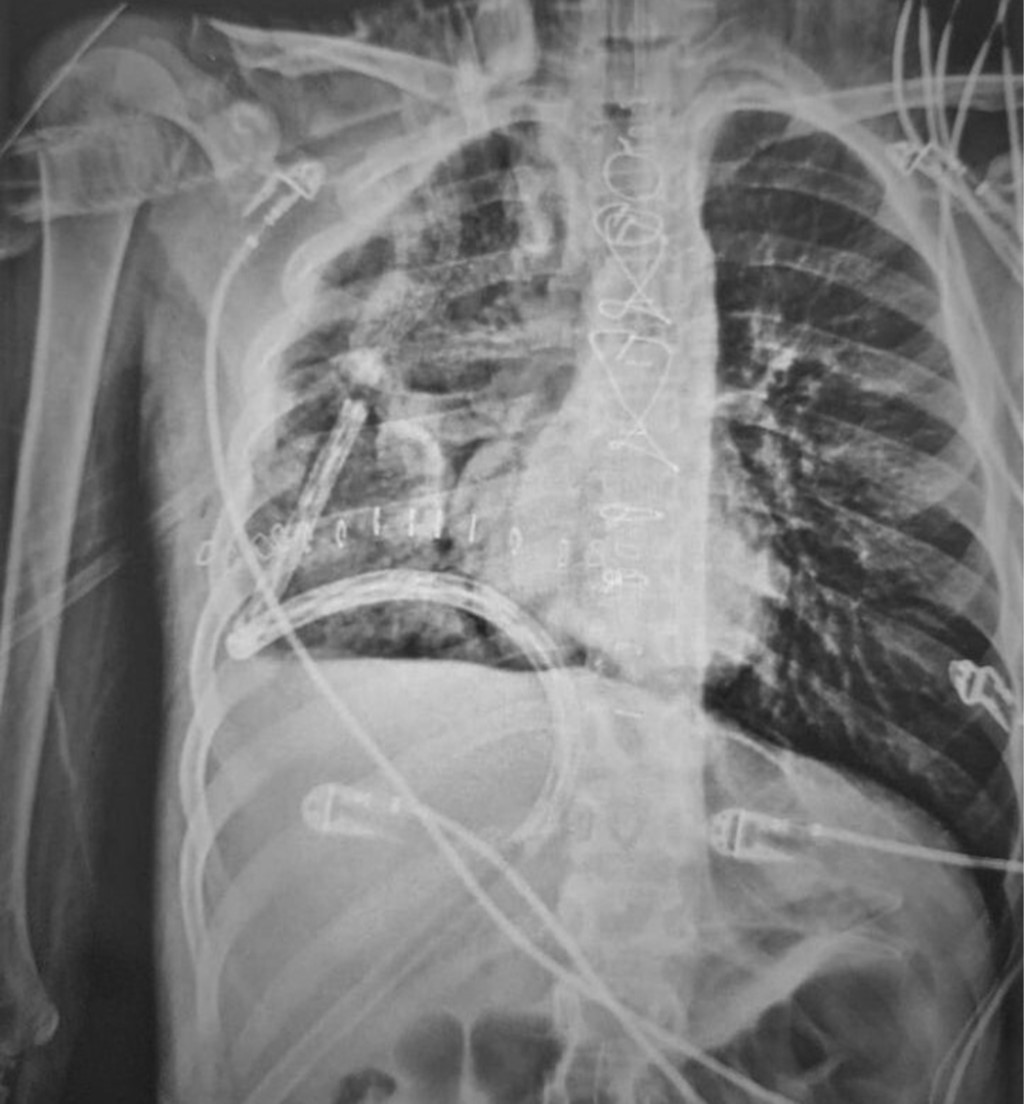
La recuperación posoperatoria transcurrió sin incidentes. Ingresó en la unidad de cuidados intensivos para manejo hemodinámico, se retira ventilación asistida 10 horas después de la operación, la radiografía de tórax control demostró expansión pulmonar completa (Figura 5). Los resultados histopatológicos revelaron un tumor germinativo mixto con componente de teratoma maduro en 70% y teratoma inmaduro en 30%. Fue dado de alta a las dos semanas posoperatorias sin ninguna complicación. Actualmente se encuentra en seguimiento oncológico por la consulta de especialidades.
Discusión
En general, los tumores de células germinativas se pueden dividir en tumores seminomatosos y tumores no seminomatosos de células germinativas.3
La presentación de manifestaciones clínicas depende del subtipo histológico, el tamaño del tumor y la rapidez del crecimiento. Los síntomas clínicos comunes de los tumores mediastínicos no seminomatosos de células germinativas son tos, disnea, dolor torácico, fiebre, sudores nocturnos y pérdida de peso. Los teratomas maduros o benignos, que son de crecimiento lento, a menudo se pueden diagnosticar incidentalmente, su manejo es quirúrgico. Rara vez el tumor puede comprimir estructuras cruciales como la vena cava superior resultando en manifestaciones del síndrome de vena cava superior como plétora facial y venas prominentes del cuello. Por otra parte, los teratomas inmaduros se comportan de manera más agresiva y tienen un peor pronóstico.5
Un examen físico completo que incluye un examen genital es crucial. La alfafetoproteína, la fracción beta de la hormona gonadotropina coriónica humana y el lactato deshidrogenasa son los marcadores tumorales que se pueden elevar en estos pacientes.6 La biopsia guiada con aguja fina es aceptada como procedimiento estándar para el diagnóstico histológico confirmatorio.7
El tratamiento de los tumores mediastínicos no seminomatosos de células germinales es la quimioterapia basada en cisplatino con bleomicina y etopósido durante cuatro ciclos; no obstante, muchos de estos pacientes persisten con células cancerígenas residuales después del tratamiento, por lo tanto, la resección quirúrgica de cualquier tumor residual tiene un papel importante en el control de la enfermedad, por lo que la resección quirúrgica mejora los resultados finales.8,9
La cirugía para este tipo de tumores es técnicamente exigente, ya que la quimioterapia preoperatoria a menudo vuelve fibróticos los tejidos mediastínicos circundantes, lo que modifica los planos anatómicos normales. Con frecuencia, las masas residuales también se adhieren a las superficies mediastínicas del pulmón, los grandes vasos, los nervios y, en ocasiones, las cámaras cardíacas.10
La planeación quirúrgica es un punto clave para el éxito de la cirugía, la inducción anestésica y el establecimiento de una vía aérea pueden ser peligrosos cuando hay una masa mediastínica; el fibroscopio óptico y el broncoscopio rígido son instrumentos que ayudan al procedimiento de intubación. Se debe considerar la posibilidad de disponer de soporte extracorpóreo de forma inmediata en los casos en que la pérdida de la vía aérea o la estabilidad hemodinámica se considere un riesgo significativo. Esta preparación incluye tener un técnico perfusionista presente en la sala quirúrgica con un circuito de bypass cardiopulmonar o un circuito de oxigenación por membrana extracorpórea.11
Conclusiones
Los tumores mediastinales de células germinales no seminomatosos son tumores agresivos que a menudo son metastásicos en el momento de la presentación. Las estrategias de tratamiento para estos tumores están determinadas en gran medida por la histología tumoral, por ejemplo, en los teratomas maduros la primera línea de tratamiento es la resección quirúrgica, en su contraparte el pilar del tratamiento para los tumores de células germinales no seminomatosos mediastínicos, incluyendo los teratomas inmaduros, es la quimioterapia seguida de una resección quirúrgica agresiva de la enfermedad residual, la cual suele ser compleja. La resección de los tumores residuales como adyuvante de la quimioterapia desempeña un papel integral en el tratamiento de estos tumores y debe completarse siempre que sea técnicamente posible. Éstas son las dos modalidades que representan un excelente modelo en el tratamiento en esta patología.
AFILIACIONES
1Instituto Mexicano del Seguro Social, Hospital General Regional (HGR) No. 1, Chihuahua, México.Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
REFERENCIAS
Nichols CR, Catalano PJ, Crawford ED, Vogelzang NJ, Einhorn LH, Loehrer PJ. Randomized comparison of cisplatin and etoposide and either bleomycin or ifosfamide in treatment of advanced disseminated germ cell tumors: an Eastern Cooperative Oncology Group, Southwest Oncology Group, and Cancer and Leukemia Group B Study. J Clin Oncol. 1998;16(4):1287-1293.