Pulmonary disease caused by nontuberculous mycobacteria: diagnosis, treatment and antimicrobial resistance mechanisms
Carreto-Binaghi, Laura1; González, Yolanda1; Guzmán-Beltrán, Silvia1
Carreto-Binaghi, Laura1; González, Yolanda1; Guzmán-Beltrán, Silvia1
ABSTRACT
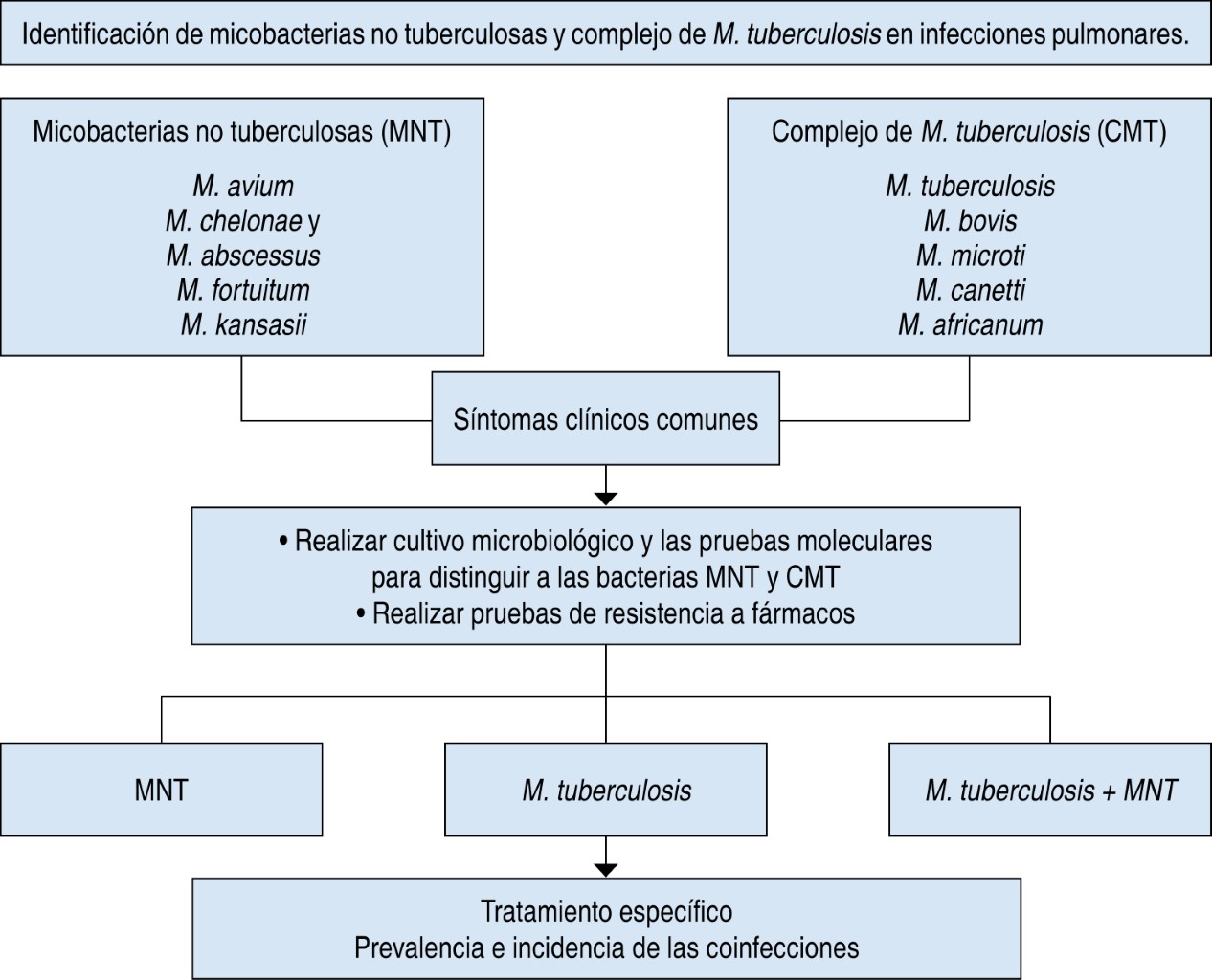
Nontuberculous mycobacteria (NTM) are emerging pathogens that affect both immunocompromised and immunocompetent patients. The incidence and prevalence of NTM lung disease have been increasing significantly around the world. Therefore, the correct diagnosis and identification of the species responsible for the infection are essential. In addition, NTM natural resistance to the most commonly used antibiotics must be considered, in order to provide appropriate treatment to each patient. Finally, it is essential to identify possible multiple infections due to strains of M. tuberculosis and NTM, which are not routinely detected and are often difficult to distinguish, because the clinical symptoms cannot differentiate a single infection from a co-infection. This review is focused on all these aspects for the benefit of patients with NTM lung disease.KEYWORDS
Nontuberculous mycobacteria, tuberculosis, bacterial resistance, antibiotics, coinfection.REFERENCES
Winthrop KL, McNelley E, Kendall B, Marshall-Olson A, Morris C, Cassidy M, et al. Pulmonary nontuberculous mycobacterial disease prevalence and clinical features: An emerging public health disease. Am J Respir Crit Care Med. 2010;182(7):977-982. Available in: https://doi.org/10.1164/rccm.201003-0503oc
Montufar Andrade FE, Aguilar Londoño C, Saldarriaga Acevedo C, Quiroga Echeverri A, Builes Montaño CE, Mesa Navas MA, et al. Características clínicas, factores de riesgo y perfil de susceptibilidad de las infecciones por micobacterias documentadas por cultivo, en un hospital universitario de alta complejidad en Medellín (Colombia). Rev Chilena Infectol. 2014;31(6):735-742. http://dx.doi.org/10.4067/S0716-10182014000600015
Griffith DE, Aksamit T, Brown-Elliott BA, Catanzaro A, Daley C, Gordin F, et al.; ATS Mycobacterial Diseases Subcommittee; American Thoracic Society; Infectious Disease Society of America. An official ATS/IDSA statement: Diagnosis, treatment, and prevention of nontuberculous mycobacterial diseases. Am J Respir Crit Care Med. 2007;175(4):367-416. Available in: https://doi.org/10.1164/rccm.200604-571st
MacFaddin JF. Pruebas bioquímicas para la identificación de bacterias de importancia clínica. 3ra. Ed. Google Libros. Buenos Aires: Médica-Panamericana; 2003:p.840. Available in: https://books.google.es/books?hl=es&lr=&id=FYWSzy7EjR0C&oi=fnd&pg=PA3&dq=Pruebas+Bioquímicas+para+la+Identificación+de+Bacterias+de+Importancia+Clínica.&ots=ROSOShLdRt&sig=mAq1g8_pqtdX9tBbmUddlcogT6s#v=onepage&q
McNabb A, Eisler D, Adie K, Amos M, Rodrigues M, Stephens G, et al. Assessment of partial sequencing of the 65-kilodalton heat shock protein gene (hsp65) for routine identification of Mycobacterium species isolated from clinical sources. J Clin Microbiol. 2004;42(7):3000-3011. Available in: https://doi.org/10.1128/jcm.42.7.3000-3011.2004
Dias MVB, Vasconcelos IB, Prado AMX, Fadel V, Basso LA, de Azevedo WFJr, et al. Crystallographic studies on the binding of isonicotinyl-NAD adduct to wild-type and isoniazid resistant 2-trans-enoyl-ACP (CoA) reductase from Mycobacterium tuberculosis. J Struct Biol. 2007;159(3):369-380. Available in: https://doi.org/10.1016/j.jsb.2007.04.009
Reingewertz TH, Meyer T, McIntosh F, Sullivan J, Meir M, Chang Y-F, et al. Differential sensitivity of mycobacteria to isoniazid is related to differences in Katg-mediated enzymatic activation of the drug. Antimicrob Agents Chemother. 2020;64(2):e01899-19. Available in: https://doi.org/10.1128/aac.01899-19
Li QJ, Jiao WW, Yin QQ, Xu F, Li JQ, Sun L, et al. Compensatory mutations of rifampin resistance are associated with transmission of multidrug-resistant Mycobacterium tuberculosis Beijing genotype strains in China. Antimicrob Agents Chemother. 2016;60(5):2807-2812. Available in: https://doi.org/10.1128/aac.02358-15
Safi H, Lingaraju S, Amin A, Kim S, Jones M, Holmes M, et al. Evolution of high-level ethambutol-resistant tuberculosis through interacting mutations in decaprenylphosphoryl-β-D-arabinose biosynthetic and utilization pathway genes. Nat Genet. 2013;45(10):1190-1197. Available in: https://doi.org/10.1038/ng.2743
Belanger AE, Besra GS, Ford ME, Mikusová K, Belisle JT, Brennan PJ, et al. The embAB genes of Mycobacterium avium encode an arabinosyl transferase involved in cell wall arabinan biosynthesis that is the target for the antimycobacterial drug ethambutol. Proc Natl Acad Sci USA. 1996;93(21):11919-11924. Available in: https://doi.org/10.1073/pnas.93.21.11919
Hobbie SN, Pfister P, Bruell C, Sander P, François B, Westhof E, et al. Binding of neomycin-class aminoglycoside antibiotics to mutant ribosomes with alterations in the A site of 16S rRNA. Antimicrob Agents Chemother. 2006;50(4):1489-1496. Available in: https://doi.org/10.1128/aac.50.4.1489-1496.2006
Prammananan T, Sander P, Brown BA, Frischkorn K, Onyi GO, Zhang Y, et al. A Single 16S ribosomal RNA substitution is responsible for resistance to amikacin and other 2-deoxystreptamine aminoglycosides in Mycobacterium abscessus and Mycobacterium chelonae. J Infect Dis. 1998;177(6):1573-1581. Available in: https://doi.org/10.1086/515328
Guillemin I, Sougakoff W, Cambau E, Revel-Viravau V, Moreau N, Jarlier V. Purification and inhibition by quinolones of DNA gyrases from Mycobacterium avium, Mycobacterium smegmatis and Mycobacterium fortuitum bv. peregrinum. Microbiology (Reading). 1999;145(Pt 9):2527-2532. Available in: https://doi.org/10.1099/00221287-145-9-2527
Sugino A, Peebles CL, Kreuzer KN, Cozzarelli NR. Mechanism of action of nalidixic acid: Purification of Escherichia coli nalA gene product and its relationship to DNA gyrase and a novel nicking-closing enzyme. Proc Natl Acad Sci USA. 1977;74(11):4767-4771. Available in: https://doi.org/10.1073/pnas.74.11.4767
Esteban J, Martín-de-Hijas NZ, Ortiz A, Kinnari TJ, Sánchez AB, Gadea I, et al. Detection of lfrA and tap efflux pump genes among clinical isolates of non-pigmented rapidly growing mycobacteria. Int J Antimicrob Agents. 2009;34(5):454-456. Available in: https://doi.org/10.1016/j.ijantimicag.2009.06.026
Hoffmann H, Kohl TA, Hofmann-Thiel S, Merker M, Beckert P, Jaton K, et al. Delamanid and bedaquiline resistance in Mycobacterium tuberculosis ancestral Beijing genotype causing extensively drug-resistant tuberculosis in a tibetan refugee. Am J Respir Crit Care Med. 2016;193(3):337-340. Available in: https://doi.org/10.1164/rccm.201502-0372le
Agizew T, Basotli J, Alexander H, Boyd R, Letsibogo G, Auld A, et al. Higher-than-expected prevalence of nontuberculous mycobacteria in HIV setting in Botswana: Implications for diagnostic algorithms using Xpert MTB/RIF assay. PLoS One. 2017;12(12):e0189981. Available in: https://doi.org/10.1371/journal.pone.0189981
Wang DM, Liao Y, Li QF, Zhu M, Wu GH, Xu YH, et al. Drug resistance and pathogenic spectrum of patients coinfected with nontuberculous mycobacteria and human-immunodeficiency virus in Chengdu, China. Chin Med J (Engl). 2019;132(11):1293-1297. Available in: https://doi.org/10.1097/cm9.0000000000000235
|
Tabla 1: Clasificación de las micobacterias no tuberculosas que causan infecciones en humanos más frecuentemente. |
|
|
Micobacterias de crecimiento lento* |
Micobacterias de crecimiento rápido‡ |
|
Grupo I. Fotocromógenas M. kansasii M. marinum M. simiae M. xenopi Grupo II. Escotocromógenas M. scrofulaceum M. gordonae M. szulgai Grupo III. No cromógenas M. avium M. chimaera M. ulcerans M. malmoense |
Grupo IV No cromógenas M. chelonae M. fortuitum M. smegmatis M. abscessus M. peregrinum M. cosmeticum M. gordonae |
|
*Lento: crecimiento visible en medio sólido en 21 días. ‡Rápido: crecimiento visible en medio sólido en menos de 7 días. |
|
|
Tabla 2: Especies de micobacterias no tuberculosas más comunes según la manifestación clínica. |
|
|
Sitios de infección |
Especie |
|
Piel |
M. marinum M. ulcerans M. abscessus |
|
Tejidos blandos y heridas quirúrgicas |
M. chimaera M. abscessus |
|
Sistémica y/o diseminada |
M. avium (complejo) M. abscessus |
|
Pulmonar |
M. avium (complejo) M. chelonae M. abscessus M. fortuitum M. kansasii M. xenopi |
|
Datos tomados a partir de: Johansen MD, Herrmann JL, Kremer L. Non-tuberculous mycobacteria and the rise of Mycobacterium abscessus. Nat Rev Microbiol. 2020;18(7):392- |
|
|
Tabla 3: Criterios diagnósticos de enfermedad pulmonar por micobacterias no tuberculosas*. |
|
Clínicos 1. Síntomas pulmonares, opacidades nodulares o cavitarias en la radiografía de tórax, o tomografía de alta resolución que muestre bronquiectasias multifocales con múltiples nódulos pequeños 2. Exclusión apropiada de otros diagnósticos.
Microbiológicos 1. Cultivos positivos en al menos dos expectoraciones tomadas por separado. Si los resultados de las muestras iniciales no son diagnósticos, considere repetir el cultivo y realizar una tinción de BAAR O bien 2. Cultivo positivo en al menos un cepillado o lavado bronquial O bien 3. Biopsia pulmonar, transbronquial u otra, con características histopatológicas de micobacterias (inflamación granulomatosa o tinción de BAAR) y cultivo positivo para MNT o biopsia con características histopatológicas de micobacterias (inflamación granulomatosa o tinción de BAAR) y uno o más esputos o lavados bronquiales con cultivos positivos para MNT 4. Se debe consultar a un experto cuando las MNT recuperadas sean poco frecuentes o generalmente representen contaminación ambiental 5. Los pacientes con sospecha de infección pulmonar por MNT que no cumplan con los criterios diagnósticos deben tener seguimiento hasta que se confirme o excluya el diagnóstico. 6. Hacer el diagnóstico de enfermedad pulmonar por MNT no necesariamente implica establecer un tratamiento, la decisión debe estar basada en los posibles riesgos y beneficios de la terapia para cada paciente |
|
*Propuestos por American Thoracic Society, 2007. BAAR = bacilos ácido-alcohol resistentes, MNT = micobacterias no tuberculosas. |
|
Tabla 4: Mecanismos de resistencia en micobacterias no tuberculosas. |
|||
|
Fármaco |
Modo de acción |
Molécula blanco |
Mecanismo de resistencia |
|
Isoniazida |
Inhibición de la síntesis de ácidos micólicos |
InhA |
*Mutación en katG o inhA (pérdida de la activación del profármaco) |
|
Rifampicina |
Inhibición de la síntesis de RNA |
RNA polimerasa |
‡Mutación en rpoB (inhibición de la ribosilación de ADP) |
|
Etambutol |
Inhibición de la síntesis de arabinogalactanos de la pared celular |
Arabinosil tranferasa |
‡Mutación en embB, embR o en el operón emb |
|
Pirazinamida |
Inhibición de síntesis de la vitamina B5 y la coenzima A |
PanD |
*Sistema de secreción que elimina POA |
|
Aminoglu- cósidos |
Inhibición de la síntesis de proteínas |
Ribosoma |
‡Mutación en el rRNA 16s, gen rpsL, aminoglucósido transferasa |
|
Fluoroqui- nolonas |
Inhibición de la síntesis de DNA |
DNA girasa |
*,‡Mutación en gyrA y ‡mutación en lfrA, proteína de secreción |
|
Bedaquilina |
Inhibición de ATP |
ATP sintasa |
‡Mutación en atpE, mmpR5, pepQ, mmpT5 |
|
Delamanida |
Inhibición de la síntesis de ácidos micólicos |
Nitro reductasa |
‡Mutación en ddn, fgd1, fbiA, fbiB, fbiC |
|
*Mutación natural o intrínseca, ‡Mutación adquirida. inhA = enoil acil reductasa; RNA = ácido ribonucleico por sus siglas en inglés; POA = ácido pirazinóico por sus siglas en inglés; PanD = aspartato decarboxilasa por sus siglas en inglés; DNA = ácido desoxiribonucléico por sus siglas en inglés; ATP = adenosín trifosfato. |
|||
|
Tabla 5: Fármacos utilizados para el tratamiento de infecciones por micobacterias no tuberculosas. |
||
|
Especie |
Guía ATS/IDSA* |
Guía BTS‡ |
|
M. abscessus |
Resección quirúrgica mínima Macrólidos (claritromicina); amikacina intravenosa; estreptomicina o cefotaxima |
Aislados sensibles a claritromicina o con resistencia inducida a macrólidos Fase inicial: ≥ un mes Amikacina, tigeciclina o imipenem vía intravenosa; claritromicina o azitromicina oral Fase de continuación: Amikacina nebulizada y claritromicina o azitromicina más clofazimina oral; linezolida, minociclina, moxifloxacina o cotrimoxazol oral, según las cPSA y la tolerancia del paciente Aislados con resistencia intrínseca a macrólidos Igual que el anterior, excepto que se omite claritromicina en ambas fases |
|
Complejo M. avium |
Infección no grave Claritromicina o azitromicina, etambutol y rifampicina Infección grave Claritromicina, azitromicina, etambutol, rifampicina, fármacos intravenosos como amikacina o estreptomicina |
Infección no grave Rifampicina, etambutol, azitromicina o claritromicina. La administración es tres veces por semana Infección grave Rifampicina, etambutol, azitromicina o claritromicina; amikacina intravenosa o nebulizada hasta por tres meses Aislados resistentes a claritromicina Rifampicina, etambutol, isoniazida (+piridoxina) o moxifloxacina; amikacina intravenosa o nebulizada hasta por tres meses |
|
M. kansasii |
Aislados sensibles a rifampicina Rifampicina, etambutol, isoniazida, piridoxina. La administración es diaria Aislados resistentes a rifampicina Régimen de tres medicamentos con base en cPSA |
Aislados sensibles a rifampicina Rifampicina, etambutol, isoniazida (+piridoxina), azitromicina o claritromicina. La administración es diaria Aislados resistentes a rifampicina Régimen de tres medicamentos con base en cPSA |
|
M. malmoense |
Isoniazida, rifampicina, etambutol, con o sin quinolonas y macrólidos con base en cPSA |
Infección no grave Rifampicina, etambutol, azitromicina o claritromicina Infección grave Igual que el anterior más amikacina intravenosa o nebulizada hasta por tres meses |
|
M. xenopi |
Isoniazida, rifabutina o rifampicina, etambutol y claritromicina, con o sin un curso inicial de estreptomicina más una quinolona, de preferencia moxifloxacina, para ser sustituido por uno de los fármacos contra TB |
Infección no grave Rifampicina, etambutol, azitromicina o claritromicina, moxifloxacina o isoniazida (+ piridoxina). La administración es diaria Infección grave Igual que el anterior más amikacina intravenosa o nebulizada hasta por tres meses |
|
*ATS/IDSA = American Thoracic Society/Infectious Disease Society of America, ‡BTS = British Thoracic Society, cPSA = prueba de sensibilidad a los antibióticos. |
||


