Exosomal biomarkers: new perspectives for the diagnosis and prognosis of respiratory diseases
Rojas-Valles, Edwin U. 1,2,3; Sánchez-Godínez, J. Yureri1,2,3; Bautista-González, A. Ixchel1,2; Garduño-Torres, Ana E. 1,2; González, Yolanda1
Rojas-Valles, Edwin U. 1,2,3; Sánchez-Godínez, J. Yureri1,2,3; Bautista-González, A. Ixchel1,2; Garduño-Torres, Ana E. 1,2; González, Yolanda1
ABSTRACT
Exosomes are small vesicles secreted by host cells after degradation of inert particles or microorganisms. Their size of < 0.1 μm allows them to migrate from the lung to different organs, carrying within them micro RNAs (miRNAs) and other host molecules. It has been reported that in non-infectious lung diseases, such as cancer, asthma, and pulmonary fibrosis, as well as in infectious diseases, such as influenza, COVID-19, pneumonia, and tuberculosis, there is a differential expression of miRNAs, and they have been proposed as biomarkers for diagnosis and/or as possible therapeutic targets. Additionally, in infectious diseases, both pathogen genetic material and host miRNAs have been found in exosomes with bimodal regulatory functions, that is, they may participate either in promoting infection or controlling disease progression. In infection with influenza viruses and SARS-CoV-2, exosomes can directly block entry into host cells by expressing the receptor on their own surface, thus suggesting them as therapeutic targets. Additionally, another function of exosomal miRNAs is as new vaccines for active and latent tuberculosis. Most of the biomarkers are still in the preclinical phase, so clinical studies are required to evaluate their efficacy as biomarkers for the diagnosis of pulmonary diseases. In this review we will focus on the most relevant information on the role of exosomal RNAs and their function in lung diseases caused by infectious and non-infectious agents, as biomarkers for diagnosis and as prognostic biomarkers, and their possible therapeutic use.KEYWORDS
Exosomes, lung diseases, miRNAs, diagnostic biomarkers.REFERENCES
Esser J, Gehrmann U, D'Alexandri FL, Hidalgo-Estévez AM, Wheelock CE, Scheynius A, et al. Exosomes from human macrophages and dendritic cells contain enzymes for leukotriene biosynthesis and promote granulocyte migration. J Allergy Clin Immunol. 2010;126(5):1032-1040.e4. doi: 10.1016/j.jaci.2010.06.039.
Vázquez-García JC, Hernández-Zenteno R de J, Pérez-Padilla JR, Cano-Salas MC, Fernández-Vega M, Salas-Hernández J, et al. Guía de Práctica Clínica Mexicana para el diagnóstico y tratamiento de la Enfermedad Pulmonar Obstructiva Crónica. Guía Mexicana de EPOC, 2020. Neumol Cir Torax. 2019;78(S1):4-76. doi: 10.35366/nts191a.
Pottier N, Maurin T, Chevalier B, Puisségur MP, Lebrigand K, Robbe-Sermesant K, et al. Identification of keratinocyte growth factor as a target of microRNA-155 in lung fibroblasts: implication in epithelial-mesenchymal interactions. Jin D-Y, ed. PLoS One. 2009;4(8):e6718. doi: 10.1371/journal.pone.0006718.
Khan MAAK, Sany MRU, Islam MS, Islam ABMMK. Epigenetic regulator miRNA pattern differences among SARS-CoV, SARS-CoV-2, and SARS-CoV-2 world-wide isolates delineated the mystery behind the epic pathogenicity and distinct clinical characteristics of pandemic COVID-19. Front Genet. 2020;11:765. doi: 10.3389/fgene.2020.00765.
Jansen F, Yang X, Hoelscher M, Cattelan A, Schmitz T, Proebsting S, et al. Endothelial microparticle-mediated transfer of microRNA-126 promotes vascular endothelial cell repair via spred1 and is abrogated in glucose-damaged endothelial microparticles. Circulation. 2013;128(18):2026-2038. doi: 10.1161/CIRCULATIONAHA.113.001720.
Dong G, Fan H, Yang Y, Zhao G, You M, Wang T, et al. 17β-Estradiol enhances the activation of IFN-α signaling in B cells by down-regulating the expression of let-7e-5p, miR-98-5p and miR-145a-5p that target IKKε. Biochim Biophys Acta-Mol Basis Dis. 2015;1852(8):1585-1598. doi: 10.1016/j.bbadis.2015.04.019.
Papageorgiou SG, Kontos CK, Tsiakanikas P, Stavroulaki G, Bouchla A, Vasilatou D, et al. Elevated miR-20b-5p expression in peripheral blood mononuclear cells: A novel, independent molecular biomarker of favorable prognosis in chronic lymphocytic leukemia. Leuk Res. 2018;70:1-7. doi: 10.1016/j.leukres.2018.04.014.
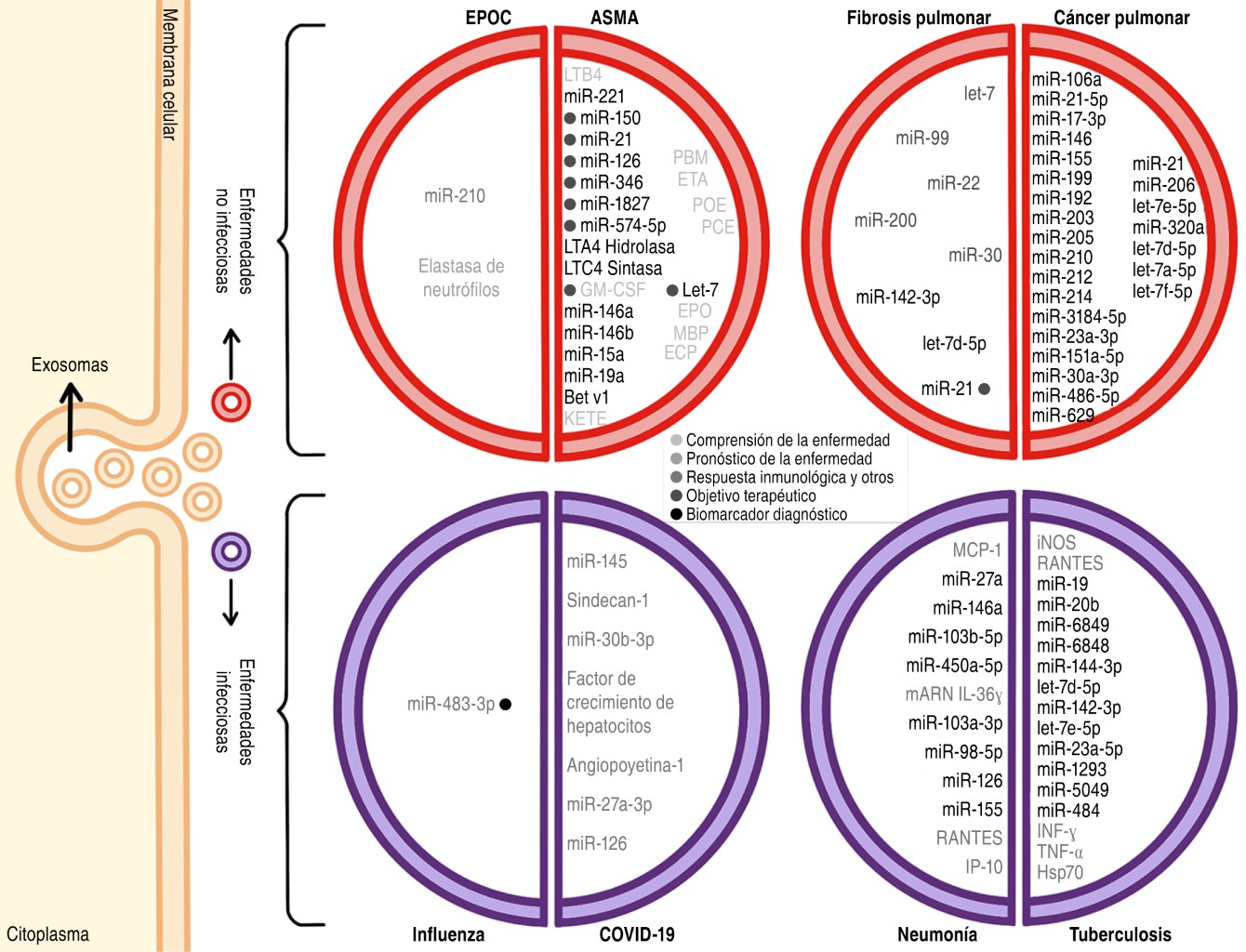
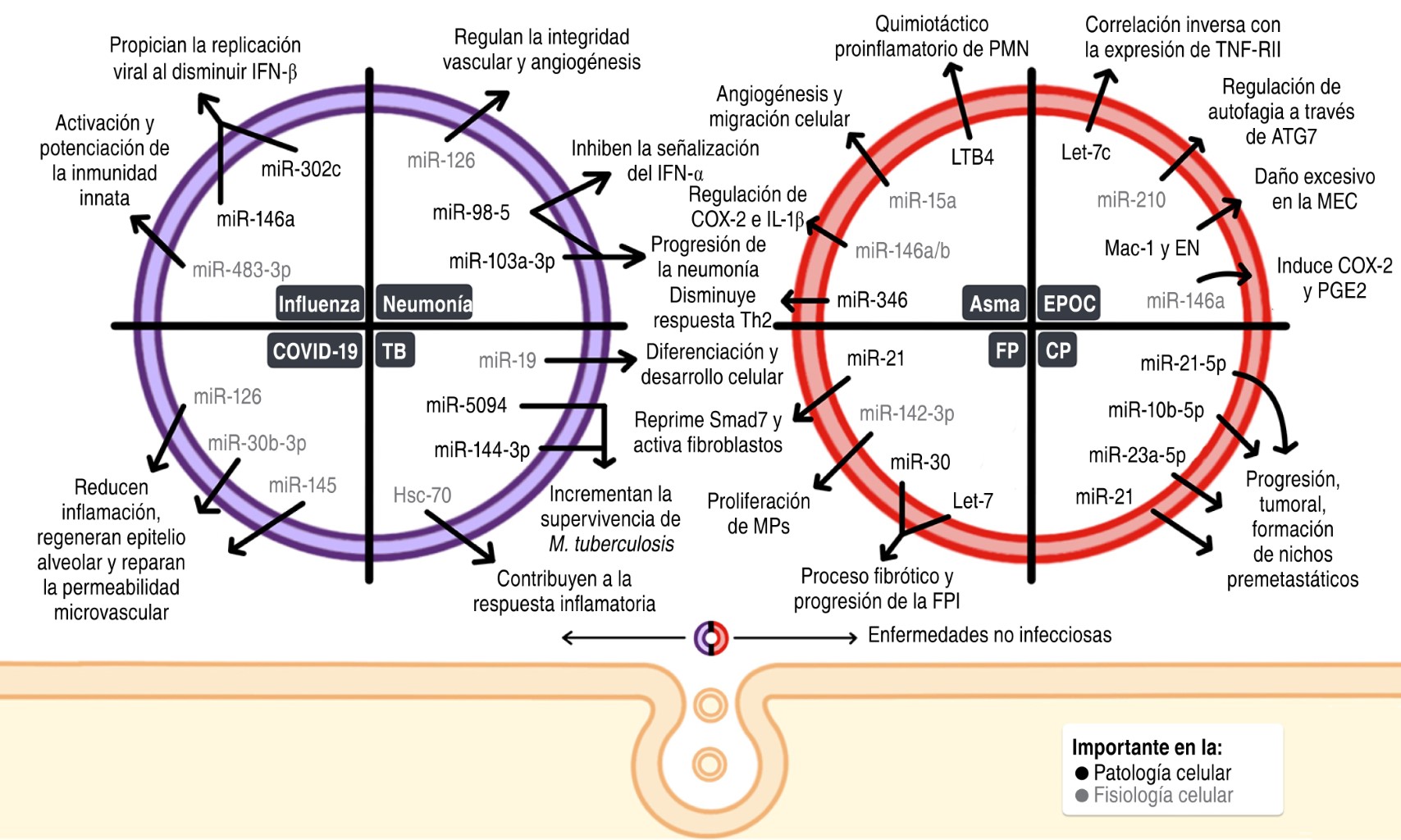
|
Tabla 1: Metabolitos y miARNs en asma. |
||||||
|
Metabolito |
Origen |
Modelo |
Efecto |
Uso |
Refe- rencia |
|
|
LTA4 hidrolasa y LTC4 sintasa |
Células dendríticas derivadas de monocitos |
In vitro, células dendríticas y macrófagos |
Pueden metabolizar LTA4 a LT proinflamatorio B4 y C4, que inducen la migración de PMN |
Objetivo terapéutico |
7,10,14 |
|
|
TGF-β1, IL-4 y GM-CSF |
Células dendríticas |
In vitro, células dendríticas |
Modifican el fenotipo de las CPA, modulan la expresión y actividad de las enzimas de la vía LT en CPA |
Diagnóstico y comprensión de la enfermedad |
7,14 |
|
|
ETA y LTB4 |
Células dendríticas |
Modelos in vitro de células dendríticas |
Quimiotácticos para eosinófilos y neutrófilos, inducen la migración de PMN y el reclutamiento de granulocitos a sitios inflamatorios |
Comprensión de la enfermedad |
7,10,11 |
|
|
TGF-β1 |
Macrófagos |
In vitro, macrófagos |
Disminuye la formación de exosomas |
Objetivo terapéutico |
10,11 |
|
|
Guanosina trifosfato fosfatasas de Rab |
Macrófagos |
In vitro, macrófagos |
Reguladores del tráfico de membranas, están involucrados en el mecanismo de liberación de exosomas |
Objetivo terapéutico |
11 |
|
|
IL-1β |
Macrófagos |
In vitro, macrófagos |
Induce la diseminación microvesicular de los monocitos de sangre periférica |
Objetivo terapéutico |
11 |
|
|
IFN-γ |
Líquido de lavado broncoalveolar |
Modelo de ratones |
Incrementa la secreción de exosomas en macrófagos alveolares |
Objetivo terapéutico |
11 |
|
|
POE, PBM y PCE |
Exosomas de eosinófilos |
Humano |
Tienen funciones autócrinas y parácrinas, y mejoran la migración de eosinófilos e inducen la expresión de moléculas de adhesión como ICAM-1 y la integrina α2 |
Comprensión de la enfermedad |
10,11 |
|
|
Bet v1 |
Células B |
Humanos |
Induce una respuesta de citocinas TH2, caracterizada por la liberación de IL-4, IL-5 e IL-13, y niveles bajos de IFN-γ y TNF-α |
Objetivo terapéutico |
11,17 |
|
|
IgE |
Células cebadas |
Humano |
Induce la estimulación y la proliferación de linfocitos, e incrementa la producción de IL-2, IL-12, IFN-γ, IL-6 e IL-8. |
Objetivo terapéutico |
10,11,12 |
|
|
CD63 y OX40L |
Células cebadas derivadas de la médula ósea |
Modelo de ratón |
Se ligan con OX40 en la superficie de las células T e inducen la proliferación de células T y la diferenciación de las células TH2 |
Objetivo terapéutico |
10,18 |
|
|
FcεRI |
Células cebadas |
Humano |
Se une a IgE libre, disminuyendo los niveles séricos de IgE, y limita los efectos de la activación de las células cebadas |
Objetivo terapéutico |
10 |
|
|
miARNs |
||||||
|
miR-150 |
Células T citotóxicas CD8 + |
Modelo de ratón |
Suprime la dermatitis alérgica de contacto e induce tolerancia de antígenos específicos en ratones |
Biomarcador diagnóstico y objetivos terapéuticos |
Disminución de la expresión |
10,16 |
|
miR-221 |
Células del músculo liso/tejido pulmonar |
Humano/modelo de ratón |
Regulación de la proliferación celular |
Biomarcador diagnóstico |
Incremento en la expresión |
11 |
|
miR-21 |
Suero |
Humano |
Regulación de la expresión de citocinas como la IL-12 |
Biomarcador diagnóstico |
Incremento en la expresión |
11 |
|
miR-346 |
Tejidos pulmonares |
Modelo de ratón |
Disminuye la respuesta TH2, regulando la expresión de IL-5 e IL-13 |
Biomarcador diagnóstico y objetivos terapéuticos |
Disminución de la expresión |
7,15 |
|
miR-1827 |
Tejidos pulmonares |
Modelo de ratón |
Disminuye la respuesta TH2, regulando la expresión de IL-5 e IL-13 |
Biomarcador diagnóstico y objetivos terapéuticos |
Disminución de la expresión |
7,15 |
|
miR-574-5p |
Tejidos pulmonares |
Modelo de ratón |
Disminuye la respuesta TH2, regulando la expresión de IL-5 e IL-13 |
Biomarcador diagnóstico y objetivos terapéuticos |
Disminución de la expresión |
7,15 |
|
miR-let-7 |
Tejidos pulmonares |
Modelo de ratón/CD4+ |
Regula la secreción de IL-13 en células T |
Biomarcador diagnóstico y objetivos terapéuticos |
Disminución de la expresión |
11,13 |
|
miR-15a |
Esputo y suero |
Células T CD4+ |
Regulación de la angiogénesis y la migración celular |
Biomarcador diagnóstico |
Disminución de la expresión |
11 |
|
miR-146a y miR-146b |
Células del músculo liso humanas |
Humano |
Regulación la expresión e inflamación de ciclooxigenasa-2 e IL-1β |
Biomarcador diagnóstico |
Disminución de la expresión |
11 |
|
miR-19a |
Esputo y suero |
Humano |
Regulación de la expresión de SOCS1 y A20 |
Biomarcador diagnóstico |
Incremento en la expresión |
11 |
|
miR-126 |
Tejido pulmonar |
Modelo de ratón |
Regulación de la inflamación |
Biomarcador diagnóstico y pronóstico |
Incremento en la expresión |
11 |
|
LTA4H hidrolasa = leucotrieno A4 hidrolasa, LTC4 sintasa = leucotrieno C4 sintasa, TGF-β1 = factor de crecimiento transformador de citocinas reguladoras beta 1, IL = interleucinas, GM-CSF = factor estimulante de colonias de granulocitos y macrófagos, LT = leucotrieno, CPA = células presentadoras de antígeno, ETA = ácido 5-cetoeicosatetraenoico, LTB4 = leucotrieno B4, PMN = leucocitos polimorfonucleares, IFN-γ = interferón-gamma, TNF-α = factor de necrosis tumoral, POE = peroxidasa de eosinófilos, PBM = proteína básica de mielina, PCE = proteína catiónica de eosinófilos, SOCS1 = supresor de la señalización de citosinas, Bet v1 = péptido de abedul, ICAM.1 = molécula de adhesión intercelular 1. |
||||||
|
Tabla 2: miARNs en la enfermedad pulmonar obstructiva crónica (EPOC). |
||||||
|
miARN |
Muestra |
Modelo |
Expresión |
Efecto |
Uso |
Refe- rencia |
|
EV-exosomas |
||||||
|
miR-210 |
Neumonectomía y lobectomía |
Humano |
Incremento en la expresión |
Regula la autofagia a través de ATG7 en fibroblastos pulmonares |
Objetivo terapéutico |
32 |
|
Células pulmonares |
||||||
|
miR-181c |
Resección pulmonar |
Humano/modelo en ratones |
Disminución en la expresión |
Regula la respuesta inflamatoria, quimiotaxis de neutrófilos, generación de especies reactivas de oxígeno |
Objetivo terapéutico |
29 |
|
miR-126 |
Sangre/in vivo |
Humano/modelo murino |
Disminución en la expresión |
Función en la angiogénesis y la homeostasis vascular |
Objetivo terapéutico |
30 |
|
miR-145 |
Las células primarias del músculo liso de los pulmones |
Humano |
Incremento en la expresión |
Regula la liberación de citocinas proinflamatorias (IL-6 y CXCL8) en las células del músculo liso por medio de la molécula SMAD3 |
Objetivo terapéutico y biomarcador diagnóstico |
31 |
|
miR-29c |
Sangre |
Humano |
Incremento en la expresión |
Es un regulador negativo de la expresión de la colágena |
Diagnóstico, estadificación y pronóstico de la enfermedad |
33,35 |
|
miR-126 |
Sangre |
Humano |
Disminución en la expresión |
Regula la producción |
Diagnóstico, estadificación y pronóstico de la enfermedad |
33,36 |
|
miR-146a |
Esputo |
Humano |
Disminución en la expresión |
Induce la expresión |
Diagnóstico, estadificación y pronóstico de la enfermedad |
27,34 |
|
miR-let- 7c |
Esputo |
Humano |
Disminución en la expresión |
Su expresión correlaciona inversamente con la concentración del TNF-RII |
Diagnóstico, estadificación y pronóstico de la enfermedad |
27,34 |
|
miR-34a |
Células microvasculares de pulmón |
Humano |
Incremento en la expresión |
Controla la expresión de AKT, y la proteína p53 |
Biomarcador diagnóstico |
28,34 |
|
miR-199a-5p |
Células microvasculares de pulmón |
Humano |
Incremento en la expresión |
Su expresión correlaciona inversamente con la expresión de la proteína HIF-1α |
Biomarcador diagnóstico |
28,34 |
|
IL = interleucinas, CXCL8 = por sus siglas en inglés C-X-C motif Chemiokine Ligand 8, SMAD3 = por sus siglas en inglés mothers against decapentaplegic homolog 3, CXCL-12 = por sus siglas en inglés C-X-C motif chemokine ligand 12, COX-2 = ciclooxigenasa-2, PGE2 = prostaglandina E2, RTFN-II = receptor del factor de necrosis tumoral tipo II. |
||||||
|
Tabla 3: miARNs en la fibrosis pulmonar. |
||||||
|
miARN |
Muestra |
Modelo |
Expresión |
Efecto |
Uso |
Refe- rencia |
|
miR-142-3p |
Esputo |
Humano |
Disminución en la expresión |
Induce la proliferación de progenitores mesenquimales mediante el control de la señalización de WNT |
Biomarcador diagnóstico |
41 |
|
miR-let-7d-5p |
Esputo |
Humano |
Disminución en la expresión |
Induce la transición mesenquimal epitelial en las células epiteliales pulmonares |
Biomarcador diagnóstico |
41 |
|
miR-21 |
Tejido pulmonar |
Modelo murino |
Incremento en la expresión |
Reprime Smad7 promoviendo la activación de fibroblastos mediada por TGF-β |
Biomarcador diagnóstico y objetivo terapéutico |
38,46,50 |
|
miR-200 |
Pulmones |
Modelo murino |
Disminución en la expresión |
Inhibe la TEM inducida por TGF-β en células epiteliales alveolares mediante la represión de los factores de transcripción GATA3, ZEB1 o ZEB2 |
Objetivo terapéutico |
38,47 |
|
miR-30 |
Células pulmonares |
Humano |
Disminución en la expresión |
Inhibe la expresión de Smad3 |
Objetivo terapéutico |
39,50 |
|
miR-99 |
Células pulmonares/tejido pulmonar |
Humano/modelo murino |
Disminución en la expresión |
Activa la señalización de TGF-β, regula la expresión de CAV1 (mediador crítico del proceso de fibrosis pulmonar) y participa en los procesos fibróticos |
Objetivo terapéutico |
39,43 |
|
miR-let-7 |
Células pulmonares/tejido pulmonar |
Humano/modelo murino |
Disminución en la expresión |
Se asocia con el proceso fibrótico |
Objetivo terapéutico |
13,34,39 |
|
miR-22 |
Tejido pulmonar |
Modelo murino |
Incremento en la expresión |
Induce la vía de señalización ERK en fibroblastos pulmonares humanos mediante la regulación de CTGF |
Objetivo terapéutico |
38,44,45 |
|
WNT = Acrónimo del gen wingless de Drosophila y de su homólogo en vertebrados integrated o Int-1, TGF-β = factor de crecimiento transformante β, TEM, β-lactamasas TEM, ZEB1 = factor transcripcional ZEB1, ZEB2 = factor transcripcional ZEB2, CAV1 = Caveolina 1, ERK = Extracellular signal-regulated kinase, CTGF = factor de crecimiento de tejido conectivo. |
||||||
|
Tabla 4: miARNs en cáncer pulmonar. |
||||||
|
miARN |
Muestra |
Modelo |
Expresión |
Análisis |
Uso |
Refe- rencia |
|
miR-17-3p, miR-21, miR-106a, miR-146, miR-155, miR-199, miR-192, miR-203, miR-205, miR 210, miR-212, miR-214, let-7b-5p, let-7e-5p, miR-23a-3p, miR-486-5p, miR-151a-5p, miR-30a-3p, miR-200b-5p, miR-629, miR-100, miR-154-3p, miR-1246 |
Tejido pulmonar |
Humano |
Incremento en la expresión |
NSCLC versus donantes sanos |
Biomarcador diagnóstico |
64,65,67 |
|
miR-132-3p, miR-181b-5p, miR-27a-3p, miR-27b-3p, miR-320a, miR-361-5p, let-7b-5p, miR-24-3p, miR-3184-5p, miR-486-5p, miR-486-3p |
Plasma |
Humano |
Incremento en la expresión |
Adenocarcinoma versus donantes sanos |
Biomarcador diagnóstico |
68 |
|
let-7a-5p, let-7d-5p, let-7f-5p, miR-26b-5p, miR-30a-3p, miR-30e-3p, miR-744-5p, let-7e-5p, miR-191-5p, miR-206, miR-21-5p, miR-23a-5p, miR-23b-5p |
Plasma |
Humano |
Disminución en la expresión |
Adenocarcinoma versus donantes sanos |
Biomarcador diagnóstico |
68 |
|
miR-320b, let-7b-5p, miR-24-3p, miR-3184-5p, miR-486-5p, miR-486-3p |
Plasma |
Humano |
Incremento en la expresión |
Carcinoma de células escamosas versus donantes sanos |
Biomarcador diagnóstico |
66 |
|
miR-10b-5p, miR-15b-5p, let-7e-5p, miR-191-5p, miR-206, miR-21-5p, miR-23a-5p, miR-23b-5p |
Plasma |
Humano |
Disminución en la expresión |
Carcinoma de células escamosas versus donantes sanos |
Biomarcador diagnóstico |
68 |
|
miR-23b-3p, miR-10b-5p, miR-21-5p |
Plasma |
Humano |
Incremento en la expresión |
Mala supervivencia cáncer pulmonar |
Biomarcador diagnóstico |
66 |
|
NSCLC = cáncer pulmonar de células no pequeñas. |
||||||
|
Tabla 5: miARNs en tuberculosis pulmonar. |
||||||
|
miARN |
Muestra |
Modelo |
Expresión |
Efecto |
Uso |
Referencias |
|
hsa-let-7e-5p y hsa-let-7d-5p |
Suero sanguíneo |
Humano |
Incremento en la expresión |
En la respuesta inmunológica hacia M. tuberculosis |
Biomarcador diagnóstico para TBL |
119,120,125,126 |
|
hsa-miR-142-3p |
Suero sanguíneo |
Humano |
Incremento en la expresión |
Modula la fagocitosis interactuando con N-Wasp en las células hospedero |
Biomarcador diagnóstico |
119,127 |
|
miR-144-3p |
Suero sanguíneo |
Humano |
Incremento en la expresión |
Inhibe la autofagia y facilita la infección por BCG induciendo ATG4a en células RAW264.7 |
Biomarcador diagnóstico |
119,128 |
|
miR-23a-5p |
Suero sanguíneo |
Humano |
Incremento en la expresión |
Induce la autofagia y la supervivencia de M. tuberculosis |
Biomarcador diagnóstico |
119,129 |
|
miR-484 |
Sangre periférica |
Humano |
Incremento en la expresión |
Regula las vías metabólicas activando la proteína de fisión mitocondrial 1 |
Biomarcador diagnóstico |
121,130,131 |
|
miR-5094 |
Sangre periférica |
Humano |
Incremento en la expresión |
Incrementa la infección por M. tuberculosis |
Biomarcador diagnóstico |
130 |
|
miR-1293 |
Sangre periférica |
Humano |
Incremento en la expresión |
Induce la expresión de mirtrones para facilitar la infección por M. tuberculosis |
Biomarcador diagnóstico |
130 |
|
miR-6848 |
Sangre periférica |
Humano |
Incremento en la expresión |
Induce la expresión de mirtrones para facilitar la infección por M. tuberculosis |
Biomarcador diagnóstico |
130 |
|
miR-6849 |
Sangre periférica |
Humano |
Incremento en la expresión |
Induce la expresión de mirtrones para facilitar la infección por M. tuberculosis |
Biomarcador diagnóstico |
130 |
|
miR-20b |
Exosomas de plasma |
Humano |
Incremento en la expresión |
Regula el factor de transcripción HIF1 y regula genes involucrados en la proliferación celular, migración, metabolismo energético, angiogénesis y apoptosis |
Biomarcador diagnóstico |
122,123 |
|
miR-19 |
Exosomas de plasma |
Humano |
Incremento en la expresión |
Diferenciación y desarrollo celular |
Biomarcador diagnóstico |
122,124 |
|
NWASP-proteína = neural del síndrome de Wiskott-Aldrich, BCG = vacuna de Bacillus Calmette-Guerin, ATC4a = Autophagy Related 4a Cysteine Peptidase, RAW264.7 = línea celular de macrófagos de ratones, HIF-1 = factor 1 inducible por hipoxia. |
||||||


