Diez años de investigación en vesículas extracelulares de células mesenquimales para tratar enfermedades pulmonares
Rescala, Gonzalo1; Ramos-de la Cruz, Ramiro1; Robles, Mónica1
Rescala, Gonzalo1; Ramos-de la Cruz, Ramiro1; Robles, Mónica1
RESUMEN
Las enfermedades pulmonares poseen altos índices de morbilidad y mortalidad en todo el mundo, y sin un tratamiento eficaz para estas enfermedades, nuevas opciones emergen. En la última década la atención se ha volcado sobre las vesículas extracelulares derivadas de células mesenquimales estromales multipotentes debido a sus propiedades inmunomoduladoras, regenerativas, antimicrobianas, antivirales, antioxidantes y antifibróticas que las sitúan incluso sobre las propias células mesenquimales estromales. En consecuencia, presentamos esta revisión con el propósito de recabar el conocimiento generado en los 10 años de investigación de la aplicación terapéutica de las vesículas extracelulares derivadas de células mesenquimales estromales multipotentes en patologías pulmonares, incluyendo la enfermedad por coronavirus 2019 (COVID-19) que ha azotado al mundo en los últimos meses. La información presentada en este artículo demuestra que, a pesar de que se requiere una mayor investigación para dilucidar por completo sus mecanismos de acción y eficacia, las vesículas extracelulares derivadas de células mesenquimales estromales multipotentes representan una opción de terapia prometedora para el tratamiento de una gran variedad de enfermedades pulmonares.PALABRAS CLAVE
Vesículas extracelulares, exosomas, células mesenquimales estromales, enfermedades pulmonares, COVID-19.Abreviaturas:
Introducción
Los pulmones son los órganos más vulnerables del cuerpo humano debido a su constante exposición al exterior. Las enfermedades pulmonares son una de las principales causas de muerte en el mundo después de las enfermedades cardiovasculares.1 Padecimientos como la enfermedad pulmonar obstructiva crónica (EPOC), la lesión pulmonar aguda/síndrome de dificultad respiratoria aguda (LPA/SDRA), la hipertensión arterial pulmonar (HAP) y la displasia broncopulmonar (DBP) encabezan las listas de las principales causas de muerte debido a sus altos índices de morbilidad y mortalidad.2-6 Adicionalmente, enfermedades respiratorias infecciosas emergentes con potencial epidémico, como la enfermedad por coronavirus 2019 (COVID-19), representan una enorme carga para los sistemas de salud y poseen un alto impacto económico y social.7
En la actualidad, no existe una cura para estas enfermedades respiratorias; sin embargo, la evidencia creciente generada en la última década sugiere que la terapia basada en células mesenquimales estromales multipotentes y vesículas extracelulares derivadas de éstas pueden ser una respuesta prometedora.8-10 En este sentido, el propósito de esta revisión es reunir la información generada en la primera década de estudio de la aplicación de las vesículas extracelulares derivadas de células mesenquimales estromales multipotentes (VECM) en la terapia contra algunas de las principales enfermedades respiratorias en diferentes modelos animales, para así identificar los huecos actuales en la investigación y las posibles direcciones a tomar en esta década que inicia.
Células mesenquimales estromales multipotentes y vesículas extracelulares derivadas
El término células mesenquimales estromales multipotentes, en adelante referidas simplemente como células mesenquimales, es la designación recomendada por la Sociedad Internacional para la Terapia Celular (ISCT) para describir a aquellas células adherentes al plástico aisladas de la médula ósea u otros tejidos como el adiposo, pulpa dental, cordón umbilical, gelatina de Wharton, placenta, tejido sinovial, el endometrio y la sangre periférica, con capacidad para expresar CD105, CD73 y CD90, incapacidad para expresar CD45, CD34, CD14 o CD11b, CD79a o CD19 y HLA clase II y que, además, puedan diferenciarse en osteoblastos, adipocitos y condroblastos.10,11
Las células mesenquimales poseen diversas propiedades, como la capacidad de migrar selectivamente hacia sitios de lesión en un mecanismo conocido como homing, que no se ha entendido completamente pero que se asume que se da de manera similar a la migración de leucocitos.12,13 También se ha demostrado que las células mesenquimales poseen propiedades regeneradoras,14 antifibróticas,15,16 antimicrobianas,17-19 inmunomoduladoras20 y antioxidantes,21 entre otras. La baja inmunogenicidad de las células mesenquimales, adicional a sus diversas propiedades, las convierten en una atractiva opción para la medicina regenerativa.22
Los mecanismos por los cuales las células mesenquimales ejercen sus múltiples propiedades no están del todo dilucidados. Inicialmente se consideró que sus efectos eran producidos debido a su capacidad de diferenciación o directamente por interacciones célula-célula; aunque estudios recientes demuestran que es probable que dicha acción sea producida por la secreción de factores solubles y/o vesículas extracelulares de manera paracrina.22-26 Recién, la atención se ha volcado sobre las VECM y aisladas de los medios condicionados para su cultivo, debido a sus propiedades comparables con las de las propias células mesenquimales.22
Las células pueden liberar a su ambiente extracelular una gran variedad de micropartículas. Algunas de estas han sido nombradas, definidas y clasificadas arbitrariamente en diversos estudios como ectosomas, vesículas desprendidas, micropartículas, vesículas derivadas de la membrana plasmática, exovesículas y el término más ampliamente utilizado, exosomas;27,28 sin embargo, debido a la falta de conceso, la Sociedad Internacional de Vesículas Extracelulares (ISEV) se refiriere a todas con el término genérico recomendado de "vesículas extracelulares".29 En la actualidad, la ISEV definió genéricamente a las vesículas extracelulares como "partículas liberadas naturalmente de la célula que están delimitadas por una bicapa lipídica y no se pueden replicar, es decir, no contienen núcleos funcionales", y sugirió clasificaciones basadas en características físicas como la densidad y el tamaño, composición bioquímica o descripción de sus condiciones o célula de origen. Cabe mencionar que la mayoría de la literatura generada sobre este tema en esta década diverge con las recomendaciones terminológicas de la ISEV, dado que estas fueron publicadas a finales de 2018.
Diversas definiciones más específicas y clasificaciones previas a las recomendaciones han sido creadas. En general, las vesículas extracelulares eran definidas como un grupo heterogéneo de micropartículas que pueden ser liberadas de cualquier célula,29 que miden entre 30-2000 nm y poseen una bicapa lipídica que protege a las moléculas que transportan, como proteínas, RNA, lípidos y metabolitos, que funcionan como un mecanismo de comunicación intercelular.30-32 Se consideraban tres clases principales de vesículas extracelulares según su biogénesis: los exosomas, las microvesículas y los cuerpos apoptóticos.27 En particular, los exosomas se consideraban como aquellas vesículas extracelulares de entre 30 y 100 nm de diámetro que son almacenadas dentro de cuerpos multivesiculares y liberadas al ambiente extracelular tras la fusión de los cuerpos multivesiculares con la membrana plasmática.33 Con el propósito de seguir las recomendaciones de la ISEV, en esta revisión nos referiremos como "vesícula extracelular" a cualquier vesícula nombrada originalmente como "exosoma" por sus autores.
Es ampliamente reconocido que las vesículas extracelulares poseen la capacidad de influenciar el microambiente de los tejidos y ejercen su acción sobre otras células a través de interacciones ligando-receptor, infusión membranal, transferencia de organelos y endocitosis.34-36 De manera adicional, se ha demostrado que las vesículas extracelulares contribuyen en varias patologías inflamatorias y activación del sistema inmune.37 Por esta razón, hace poco se ha comenzado a estudiar la viabilidad de las vesículas extracelulares, en especial aquellas derivadas de células mesenquimales, como una opción efectiva para el diagnóstico y tratamiento de numerosas patologías.22,31
VECM en modelos de patologías pulmonares
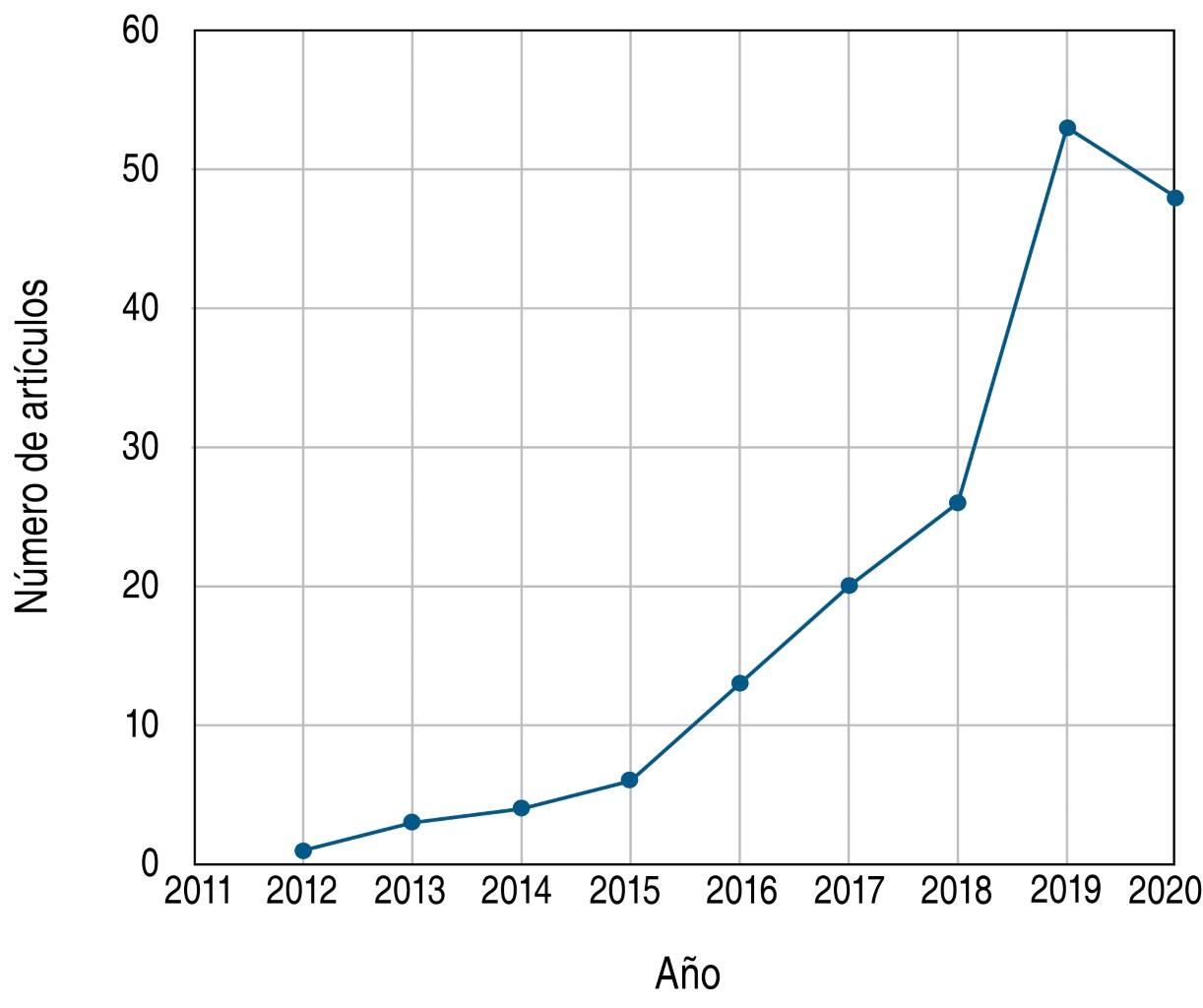
Las propiedades de las VECM han sido estudiadas en diversos modelos animales de órganos como corazón, riñón, hígado y cerebro.22 Recién ha surgido un enorme interés en su estudio para el tratamiento de lesiones y enfermedades respiratorias, durante el último año de manera substancial debido al surgimiento del SARS-CoV-2 a finales de 2019 (Figura 1).
El primer reporte de la utilización de VECM en modelos animales de pulmón data de 2012;33 sin embargo, estudios previos reportaron la aplicación exitosa de células mesenquimales en modelos animales de diversas patologías pulmonares como lesiones,38-40 DBP41,42 y HAP.43,44 En estos estudios se observó que después de la administración de las células mesenquimales existía una mayor supervivencia de los modelos, mejoras en las lesiones, decremento en la inflamación pulmonar y la fibrosis e inhibición en el caso de aquellos modelos de HAP. Algunos estudios reportaron el involucramiento de factores paracrinos en la acción terapéutica de las células mesenquimales en estas patologías,41,45 de manera similar al comportamiento observado en estudios de la administración de células mesenquimales en modelos de patologías de órganos distintos.26
Hipertensión arterial pulmonar
La HAP es una patología de etiología desconocida que se caracteriza por una remodelación vascular pulmonar que progresa en un aumento en la resistencia vascular pulmonar, disfunción ventricular derecha y muerte.46 Se calcula que la tasa de mortalidad de esta patología a tres años es de menos de 60%,47 por lo que la búsqueda de un tratamiento efectivo es una prioridad. En la última década, diversos estudios demostraron que las VECM podrían representar una opción segura para el tratamiento de esta patología a través del mejoramiento o reversión de sus manifestaciones clínicas y sus consecuencias, como lo son el alza en la presión arterial pulmonar y la inflamación o hipertrofia del ventrículo derecho, remodelación vascular, entre otros.
Numerosas investigaciones observaron la supresión del desarrollo de HAP, la remodelación vascular, la hipertrofia del ventrículo derecho, bajas en la presión pulmonar, formación de vasos sanguíneos después de la administración de VECM en diversos modelos. Dichos efectos terapéuticos de las VECM fueron producidos por la supresión de mecanismos responsables de la inflamación,33 reclutamiento de macrófagos al pulmón,48 regulación sobre la expresión de genes como el WNT5a,49 inhibición de enzimas remodeladoras de la matriz extracelular en arterias pulmonares (i.e., LOX y MMP-9).50 Por último, se observó que las VECM poseen la capacidad de revertir la HAP después de sanar células progenitoras endoteliales derivadas de la médula ósea.51
Lesión pulmonar aguda y síndrome de dificultad respiratoria aguda
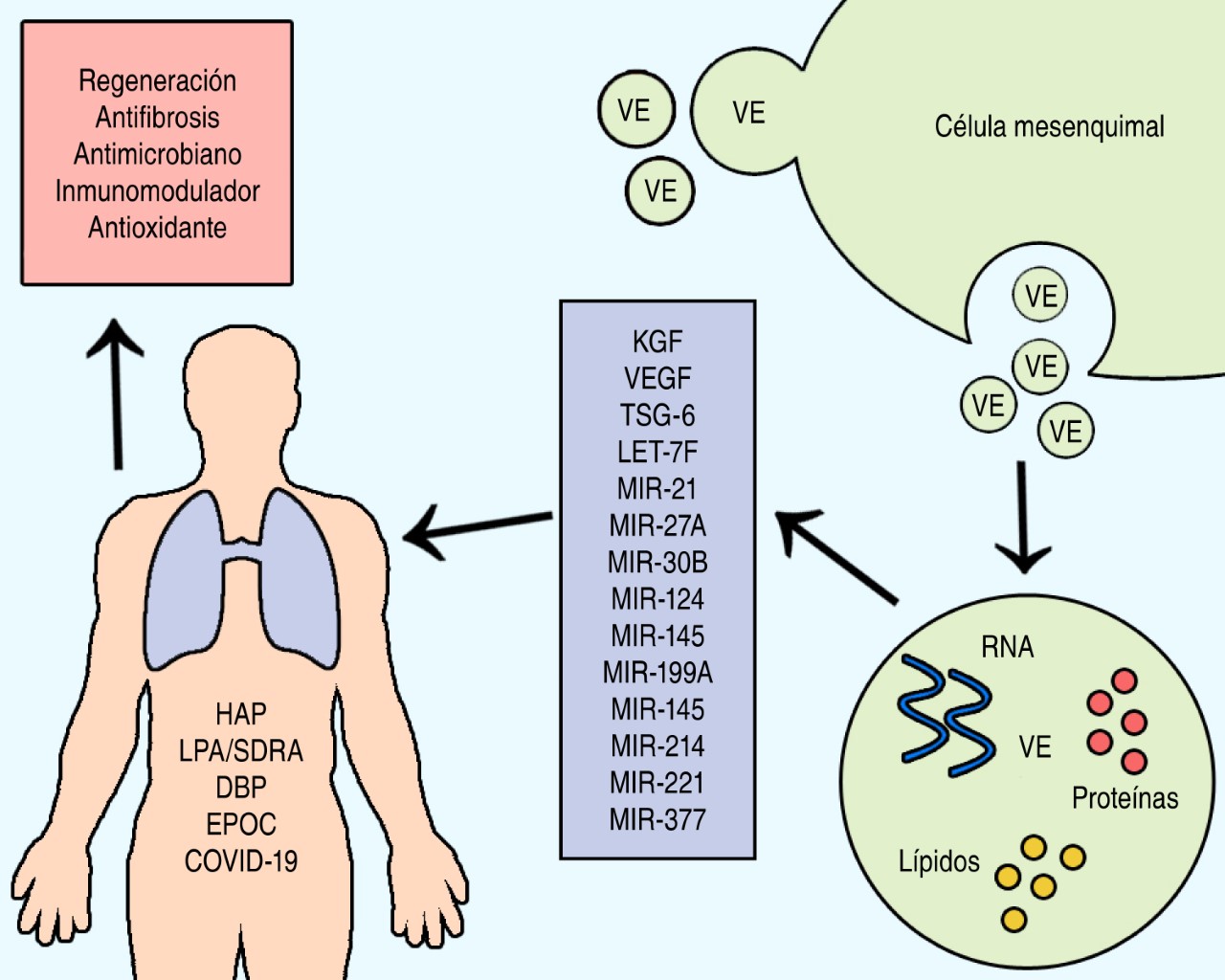
La LPA y el SDRA son dos patologías sin tratamiento que presentan una mortalidad de hasta 40%.52 Diversas publicaciones han demostrado la acción terapéutica de las VECM para el tratamiento de las manifestaciones de la LPA/SDRA en modelos animales. Se encontró que las VECM poseen capacidades protectoras contra LPA,53 inducen la recuperación pulmonar,54,55 reducen el edema pulmonar56 y la inflamación.57-59 Las VECM también reducen la fibrosis, el daño vascular y genético en lesiones por radiación,60 la apoptosis de las células epiteliales pulmonares,53,58 inducen autofagia61 y elevan la capacidad fagocitaria de macrófagos.36 En estos estudios se atribuyeron los efectos terapéuticos mayormente a la participación de factores de crecimiento como el factor de crecimiento de queratinocitos (KGF),54,57 transferencia de moléculas de RNA (miR-124-3p, miR-30b-3p, miR-214-3p, miR-377-3p, miR-27a-3p, miR-145)53,55,57,60-63 y mitocondrias.36
Displasia broncopulmonar (DBP)
La DBP es una enfermedad considerada como un desorden del desarrollo pulmonar que se caracteriza por la interrupción en la tabicación de los alvéolos e hipoplasia alveolar que conduce a un menor número de alvéolos más grandes (simplificación alveolar) y, por lo tanto, a una menor superficie disponible para el intercambio de gases. La DBP se presenta casi siempre en bebés pretérminos de bajo peso que requieren ventilación mecánica y terapia con oxígeno, aunque también se presenta en bebés a término que requieren apoyo ventilatorio agresivo para enfermedades pulmonares agudas y severas.4 La DBP está asociada a complicaciones pulmonares a largo plazo, como función pulmonar anormal e hipertensión pulmonar secundaria.64 No existen aún terapias para prevenir o tratar las lesiones pulmonares durante el desarrollo, por lo que nuevas terapias son necesarias.
En la última década se dio un avance moderado en el estudio de las VECM para el tratamiento de las manifestaciones de la DBP. Estudios encontraron que las VECM favorecen el desarrollo pulmonar,64 atenúan lesiones pulmonares,65,66 suprimen la inflamación64 y la respuesta inmune,64 estimulan la formación de vasos sanguíneos,67,68 inhiben la hipertrofia del ventrículo derecho,67 mejoran la simplificación alveolar68 y la fibrosis pulmonar.68 Además se encontró que las VECM mejoran las patologías de pulmón, corazón y cerebro relacionadas a la DPB.69 Sólo algunos de estos estudios identificaron los mecanismos terapéuticos de las VECM y encontraron acciones mediadas por la transferencia del factor de crecimiento vascular endotelial (VEGF)65,67 y la proteína del gen 6 inducible por factor de necrosis tumoral (TSG-6).69
Enfermedad pulmonar obstructiva crónica (EPOC)
La EPOC es una enfermedad de impacto mundial enorme con altas tasas de morbilidad y mortalidad. La Organización Mundial de la Salud (OMS) calcula que existen alrededor de 65 millones de personas con EPOC en todo el mundo, y que en 2030 será la cuarta causa de muerte.70 La EPOC se caracteriza por una limitación progresiva del flujo del aire en las vías aéreas, acompañada de una respuesta inflamatoria crónica a partículas o gases, como el humo del cigarro. Los tratamientos actuales se basan en aliviar los síntomas, pero en etapas avanzadas las vías se obstruyen y el parénquima pulmonar es destruido.71,72 En los últimos años, un par de estudios en modelos han mostrado la posibilidad de la aplicación de las VECM en el tratamiento de las manifestaciones y los daños producidos por la EPOC. Una primera investigación encontró que las VECM regulaban el proceso de transición epitelial-mesenquimal provocado por EPOC de manera indirecta a través del miR-21.73 También se ha encontrado que la transferencia de mitocondrias puede ser el mecanismo responsable de la disminución de inflamación pulmonar producida por el humo de cigarro en un modelo murino.74
Enfermedad por coronavirus 2019 y otras infecciones virales
La COVID-19 producida por el coronavirus tipo 2 del síndrome respiratorio agudo grave (SARS-CoV-2), se ha convertido en una emergencia sanitaria global desde la detección del primer caso en Wuhan, China en diciembre de 2019. Hasta el 12 de octubre de 2020, más de un millón de muertos han sido reportados y una vacuna no ha sido desarrollada.7 Se ha reportado que una larga proporción de pacientes sufre disnea, hipoxemia, neumonía, falla respiratoria y SDRA, con este último contribuyendo en gran medida a la muerte de muchos pacientes.75 En el inicio de la infección, la proteína pico del virus reconoce el receptor de la enzima convertidora de angiotensina II (ECA2), presente en las células humanas y que son altamente expresadas en células alveolares tipo 2, provocando una sobrerreacción del sistema inmunológico a la entrada de las partículas virales a las células. La sobrerreacción del sistema inmunológico consiste en la liberación de grandes cantidades de citocinas proinflamatorias (IFN-alfa, IFN-gamma, IL-1 beta, IL-6, IL-12, IL-18, IL-33, TNF-alfa, TGF-beta) y quimiocinas (CCL2, CCL3, CCL5, CXCL8, CXCL9, CXCL10) por las células efectoras inmunes en un mecanismo conocido como "tormenta de citocinas", el cual provoca que el sistema inmunitario ataque el cuerpo produciendo SDRA, falla multiorgánica y muerte.76,77
Múltiples estrategias se han elaborado para el tratamiento de la infección, desde la terapia de apoyo hasta la administración de antivirales y la terapia con plasma y anticuerpos;76 sin embargo, sin un tratamiento específico para el SDRA, las muertes continúan en aumento. En este sentido, la supresión de la inflamación producida por la tormenta de citocinas se convierte en un blanco para la prevención y tratamiento del SDRA y las lesiones pulmonares inducidas por el SARS-CoV-2. El tratamiento con células mesenquimales ha demostrado ser seguro y eficaz en diversos ensayos clínicos de enfermedades pulmonares,78 incluyendo SDRA79-81 y el propio COVID-19;82-84 no obstante, algunos autores han reportado desventajas de su uso, como la agregación celular que puede conducir a embolia si la administración es intravenosa, o riesgos de mutagenicidad y tumorigenicidad si la fuente de las células es tejido embrionario.85 En consecuencia, las VECM representan una opción viable de tratamiento debido a las propiedades terapéuticas que replican de sus células progenitoras y sus ventajas sobre éstas.86,87 Hasta la fecha, ningún estudio utilizando VECM ha sido publicado, aunque un gran número de publicaciones han sugerido la aplicación de la terapia con células mesenquimales y VECM en casos con esta enfermedad.31,77,88-90
Por último, en esta década se condujeron algunos estudios con el propósito de probar los efectos terapéuticos de las células mesenquimales y VECM en infecciones provocadas por virus como la influenza91,92 y la hepatitis C.93 Estas publicaciones demostraron que las VECM poseen la capacidad de inhibir la replicación del virus, la apoptosis y la producción de citocinas proinflamatorias inducida por el virus en células epiteliales pulmonares a través de la acción de miRNAs (e.g., let-7f, miR-145, miR-199a, y miR-221) transportados por las VECM.91,93
Conclusiones y perspectivas
Las patologías pulmonares son un problema de salud grave que requiere la búsqueda de terapias alternas a la medicina convencional. El conocimiento generado en esta primera década de investigación indica que las VECM podrían representar un tratamiento seguro para diversas enfermedades pulmonares. La evidencia obtenida hasta ahora indica que las proteínas, lípidos y miRNAs transportadas dentro de las VECM juegan un papel esencial en los efectos benéficos de las VECM (Figura 2). La investigación futura en este campo debe continuar y enfocarse en lo siguiente: 1) dilucidar de manera más profunda los mecanismos básicos que son responsables de los efectos terapéuticos; 2) identificar las moléculas específicas responsables de los efectos terapéuticos; 3) realizar aún más ensayos clínicos para evaluar la seguridad y eficacia de los tratamientos acelulares con VECM; y 4) el desarrollo de biofármacos basados en VECM para el tratamiento de patologías pulmonares específicas.
AFILIACIONES
1Exocel, Tijuana, Baja California, México.Conflicto de intereses: Los autores declaran conflicto de intereses por su relación laboral con Exocel S.A. de C.V.
Financiamiento: El financiamiento para la escritura de este manuscrito fue proporcionado por Exocel S.A. de C.V.
REFERENCIAS
Kassebaum NJ, Arora M, Barber RM, Bhutta ZA, Brown J, Carter A, et al.; GBD 2015 DALYs and HALE Collaborators. Global, regional, and national disability-adjusted life-years (DALYs) for 315 diseases and injuries and healthy life expectancy (HALE), 1990-2015: a systematic analysis for the Global Burden of Disease Study 2015. Lancet. 2016; 388(10053): 1603-1658. Available in: https://doi.org/10.1016/s0140-6736(16)31460-x
Hoeper MM, Kramer T, Pan Z, Eichstaedt CA, Spiesshoefer J, Benjamin N, et al. Mortality in pulmonary arterial hypertension: prediction by the 2015 European pulmonary hypertension guidelines risk stratification model. Eur Respir J. 2017; 50(2): 1700740. Available in: https://doi.org/10.1183/13993003.00740-2017
Wang H, Naghavi M, Allen C, Barber RM, Bhutta ZA, Carter A, et al.; GBD 2015 Mortality and Cause of Death Collaborators. Global, regional, and national life expectancy, all-cause mortality, and cause-specific mortality for 249 causes of death, 1980–2015: a systematic analysis for the Global Burden of Disease Study 2015. Lancet. 2016; 388(10053): 1459-1544. Available in: https://doi.org/10.1016/s0140-6736(16)31012-1
Kotani T, Masutani R, Suzuka T, Oda K, Makino S, Ii M. Anti-inflammatory and anti-fibrotic effects of intravenous adipose-derived stem cell transplantation in a mouse model of bleomycin-induced interstitial pneumonia. Sci Rep. 2017; 7(1): 14608. Available in: https://doi.org/10.1038/s41598-017-15022-3
Lotvall J, Hill AF, Hochberg F, Buzás EI, Di Vizio D, Gardiner C, et al. Minimal experimental requirements for definition of extracellular vesicles and their functions: a position statement from the International Society for Extracellular Vesicles. J Extracell Vesicles. 2014; 3: 26913. https://doi.org/10.3402/jev.v3.26913
Théry C, Witwer KW, Aikawa E, Alcaraz MJ, Anderson JD, Andriantsitohaina R, et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. J Extracell Vesicles. 2018; 7(1): 1535750. Available in: https://doi.org/10.1080/20013078.2018.1535750
Morrison TJ, Jackson MV, Cunningham EK, Kissenpfennig A, McAuley DF, O'Kane CM, et al. Mesenchymal stromal cells modulate macrophages in clinically relevant lung injury models by extracellular vesicle mitochondrial transfer. Am J Respir Crit Care Med. 2017; 196(10): 1275-1286. Available in: https://doi.org/10.1164/rccm.201701-0170oc
Baber SR, Deng W, Master RG, Bunnell BC, Taylor BK, Murthy SN, et al. Intratracheal mesenchymal stem cell administration attenuates monocrotaline-induced pulmonary hypertension and endothelial dysfunction. Am J Physiol Heart Circ Physiol. 2007; 292(2): H1120-H1128. Available in: https://doi.org/10.1152/ajpheart.00173.2006
Humbert M, Sitbon O, Chaouat A, Bertocchi M, Habib G, Gressin V, et al. Survival in patients with idiopathic, familial, and anorexigen-associated pulmonary arterial hypertension in the modern management era. Circulation. 2010; 122(2): 156-163. Available in: https://doi.org/10.1161/circulationaha.109.911818
Aliotta JM, Pereira M, Wen S, Dooner MS, Del Tatto M, Papa E, et al. Bone marrow endothelial progenitor cells are the cellular mediators of pulmonary hypertension in the murine monocrotaline injury model. Stem Cells Transl Med. 2017; 6(7): 1595-1606. Available in: https://doi.org/10.1002/sctm.16-0386
Willis GR, Fernandez-Gonzalez A, Anastas J, Vitali SH, Liu X, Ericsson M, et al. Mesenchymal stromal cell exosomes ameliorate experimental bronchopulmonary dysplasia and restore lung function through macrophage immunomodulation. Am J Respir Crit Care Med. 2018; 197(1): 104-116. Available in: https://doi.org/10.1164/rccm.201705-0925oc
Ahn SY, Park WS, Kim YE, Sung DK, Sung SI, Ahn JY, et al. Vascular endothelial growth factor mediates the therapeutic efficacy of mesenchymal stem cell-derived extracellular vesicles against neonatal hyperoxic lung injury. Exp Mol Med. 2018; 50(4): 1-12. Available in: https://doi.org/10.1038/s12276-018-0055-8
Porzionato A, Zaramella P, Dedja A, Guidolin D, Van Wemmel K, Macchi V, et al. Intratracheal administration of clinical-grade mesenchymal stem cell-derived extracellular vesicles reduces lung injury in a rat model of bronchopulmonary dysplasia. Am J Physiol Lung Cell Mol Physiol. 2019; 316(1): L6-L19. Available in: https://doi.org/10.1152/ajplung.00109.2018
Willis GR, Fernandez-Gonzalez A, Reis M, Yeung V, Liu X, Ericsson M, et al. Mesenchymal stromal cell-derived small extracellular vesicles restore lung architecture and improve exercise capacity in a model of neonatal hyperoxia-induced lung injury. J Extracell Vesicles. 2020; 9(1). 1790874. Available in: https://doi.org/10.1080/20013078.2020.1790874
Chaubey S, Thueson S, Ponnalagu D, Alam MA, Gheorghe CP, Aghai Z, et al. Early gestational mesenchymal stem cell secretome attenuates experimental bronchopulmonary dysplasia in part via exosome-associated factor TSG-6. Stem Cell Res Ther. 2018; 9(1):173. Available in: https://doi.org/10.1186/s13287-018-0903-4
Le Thi Bich P, Nguyen Thi H, Dang Ngo Chau H, Phan Van T, Do Q, Dong Khac H, et al. Allogeneic umbilical cord-derived mesenchymal stem cell transplantation for treating chronic obstructive pulmonary disease: a pilot clinical study. Stem Cell Res Ther. 2020; 11(1): 60. Available in: https://doi.org/10.1186/s13287-020-1583-4
Taghavi-Farahabadi M, Mahmoudi M, Soudi S, Hashemi SM. Hypothesis for the management and treatment of the COVID-19-induced acute respiratory distress syndrome and lung injury using mesenchymal stem cell-derived exosomes. Med Hypotheses. 2020;144: 109865. Available in: https://doi.org/10.1016/j.mehy.2020.109865
Chen J, Hu C, Chen L, Tang L, Zhu Y, Xu X, et al. Clinical study of mesenchymal stem cell treatment for acute respiratory distress syndrome induced by epidemic Influenza A (H7N9) infection: a hint for COVID-19 treatment. Engineering (Beijing). 2020; 6(10): 1153-1161. Available in: https://doi.org/10.1016/j.eng.2020.02.006
Matthay MA, Calfee CS, Zhuo H, Thompson BT, Wilson JG, Levitt JE, et al. Treatment with allogeneic mesenchymal stromal cells for moderate to severe acute respiratory distress syndrome (START study): a randomised phase 2a safety trial. Lancet Respir Med. 2019; 7(2): 154-162. Available in: https://doi.org/10.1016/s2213-2600(18)30418-1
Liao G, Zheng K, Lalu MM, Fergusson DA, Allan DS. A scoping review of registered clinical trials of cellular therapy for COVID-19 and a framework for accelerated synthesis of trial evidence-FAST evidence. Transfus Med Rev. 2020; 34(3): 165-171. Available in: https://doi.org/10.1016/j.tmrv.2020.06.001