Seguimiento ambulatorio de pacientes con displasia broncopulmonar
Jamaica-Balderas, Lourdes María del Carmen1; Fonseca-Larios, Waldo Moisés1; Romero-Mena, Fabián1; Barragán-González, Arelis1
Jamaica-Balderas, Lourdes María del Carmen1; Fonseca-Larios, Waldo Moisés1; Romero-Mena, Fabián1; Barragán-González, Arelis1
RESUMEN
PALABRAS CLAVE
Displasia broncopulmonar, enfermedad pulmonar, recién nacido prematuro, prematuro, enfermedades del prematuro.Introducción
La displasia broncopulmonar (DBP) fue descrita por Northway, Rosen y Porter (1967), como una enfermedad pulmonar en recién nacidos prematuros, con requerimiento de ventilación mecánica prolongada y altos niveles de oxígeno suplementario1,2 y se define por la duración total de uso de oxígeno suplementario, requerimiento de presión positiva y edad gestacional, así como por dependencia del oxígeno a las 36 semanas de edad postnatal.3,4
La incidencia en centros de atención varía entre 20 y 75%.5 Estudios de cohortes como ELGAN, Canadian Neonatal Network, Korean Neonatal Network, Vermont-Oxford Network y Swiss Neonatal Network, y estudios realizados en China, Taiwan e India, muestran prevalencias entre el 11 y 50%, dadas por diferencias relacionadas con criterios de edad gestacional o peso al nacer asociados al diagnóstico.6
La variación en los desenlaces neonatales identificados en cohortes multicéntricas y multinacionales puede resultar de diferencias en cobertura, características poblacionales, estructura de la atención en salud perinatal, definiciones de caso, calidad y procesos de atención en los diferentes países.1
Los factores de riesgo son varios entre ellos restricción del crecimiento intrauterino, sexo masculino, corioamnioitis, raza, tabaquismo1 e incluso el riesgo genético.7-10
Desde 2005, la prevalencia de DBP del Vermont Oxford Network se ha reducido, pasando de 31 a 28%. A nivel mundial, las tasas de DBP oscilaron entre 13 y 32% en la iNEO (International Network for Evaluation Outcomes in Neonates) entre 2007-2010.6,11-15
Evaluaciones recientes en EUA indican que la DBP se desarrolla en aproximadamente 10% de los prematuros nacidos entre las 28 y 31 semanas, y en 40% de los prematuros menores de 28 semanas.16 En Europa, 10 a 20% de los prematuros entre las 23 y 31 semanas desarrollaron DBP.16 En México la prevalencia de pretérmino es de 10%, de los cuales un 8 a 12% son de menos de 1.200 g o menos de 32 semanas, siendo esta la población susceptible de desarrollar DBP.17
Aunque la DBP sigue siendo la complicación más frecuente en menores a 30 semanas y bajo peso al nacer, en los últimos 50 años el manejo ha evolucionado por el uso de corticosteroides prenatales, técnicas avanzadas en atención neonatal y uso de surfactante, permitiendo que los recién nacidos con DBP tengan mejor sobrevida y menor riesgo de mortalidad, aunque favorece el aumento de la prevalencia.1,18,19
A pesar de todos los esfuerzos para prevenir la lesión pulmonar, ésta continúa siendo la enfermedad pulmonar crónica más prevalente en el prematuro,20 caracterizada por inflamación uniforme, fibrosis en bajo grado, ausencia de metaplasia epitelial en vías respiratorias, hipertrofia del músculo liso, alvéolos más grandes y disfunción vascular pulmonar.21
El cuidado del prematuro extremo requiere hospitalización de aproximadamente 60 días, y en algunos casos de rehospitalizaciones después del alta.5 Durante su primer año de vida, 49% requieren reingreso.22,23 Estudios de seguimiento son importantes porque permiten visualizar la afectación pulmonar, síntomas parecidos al asma, hipertensión pulmonar e intolerancia al ejercicio con respuesta alterada a la hipoxia.24
En este trabajo, nuestro objetivo fue describir retrospectivamente las características demográficas, factores asociados y comorbilidades en pacientes con DBP que asistieron a consulta externa de Neumología pediátrica entre 2014 a 2018.
Material y métodos
Se realizó estudio observacional, descriptivo, retrospectivo, en 386 pacientes con diagnóstico de DBP quienes cumplieron con la definición según Bancalari (Tabla 1), y fueron atendidos en consulta externa de Neumología del Hospital Infantil de México "Federico Gómez" entre los años 2014 a 2018. No se incluyeron pacientes con cardiopatía congénita cianosante o con historia clínica incompleta.
Los datos para este estudio fueron tomados de las historias clínicas y se evaluó información de las atenciones recibidas en los dos primeros años de vida. Las variables cualitativas se reportaron como frecuencias absolutas y relativas y las variables cuantitativas con medianas y rangos, previa verificación del supuesto de normalidad con el test Shapiro-Wilk. La comparación entre grupos de acuerdo con la gravedad de la DPB se realizó empleando la prueba de χ2 y el test exacto de Fisher para las variables cualitativas y el test de Kruskal-Wallis para variables cuantitativas; un valor p < 0,050 fue considerado significativo. Los análisis estadísticos se realizaron en STATA v.14.
Este proyecto contó con la aprobación del Comité de Ética Institucional y se realizó bajo los lineamientos establecidos en la Declaración de Helsinki y la normatividad local.25
Resultados
Se analizaron retrospectivamente 386 historias clínicas de pacientes con diagnóstico de DBP quienes cumplieron los criterios de inclusión y asistieron a consulta de Neumología. Tres pacientes no fueron incluidos en el análisis, uno por presentar cardiopatía congénita es cianosante y dos por historia clínica incompleta, 57,51% (n = 222) fue de sexo masculino, con una mediana de edad gestacional de 31 semanas (rango: 28 a 35 semanas), 73,83% (n = 282) de los pacientes nació antes de la semana 34 de gestación y tuvo una mediana de peso al nacer de 1.305 g (rango: 1.016 a 2.087 g) (Tabla 2).
Se clasificaron los pacientes según la gravedad de la DBP en leve, moderada y grave según el tiempo de uso de oxígeno suplementario y el uso de presión positiva en la vía aérea, 47,15% (n = 182) de los casos fueron clasificados como DBP moderada, 33,68% (n = 130) como DBP grave y 18,39% (n = 71) como DBP leve (Tabla 2).
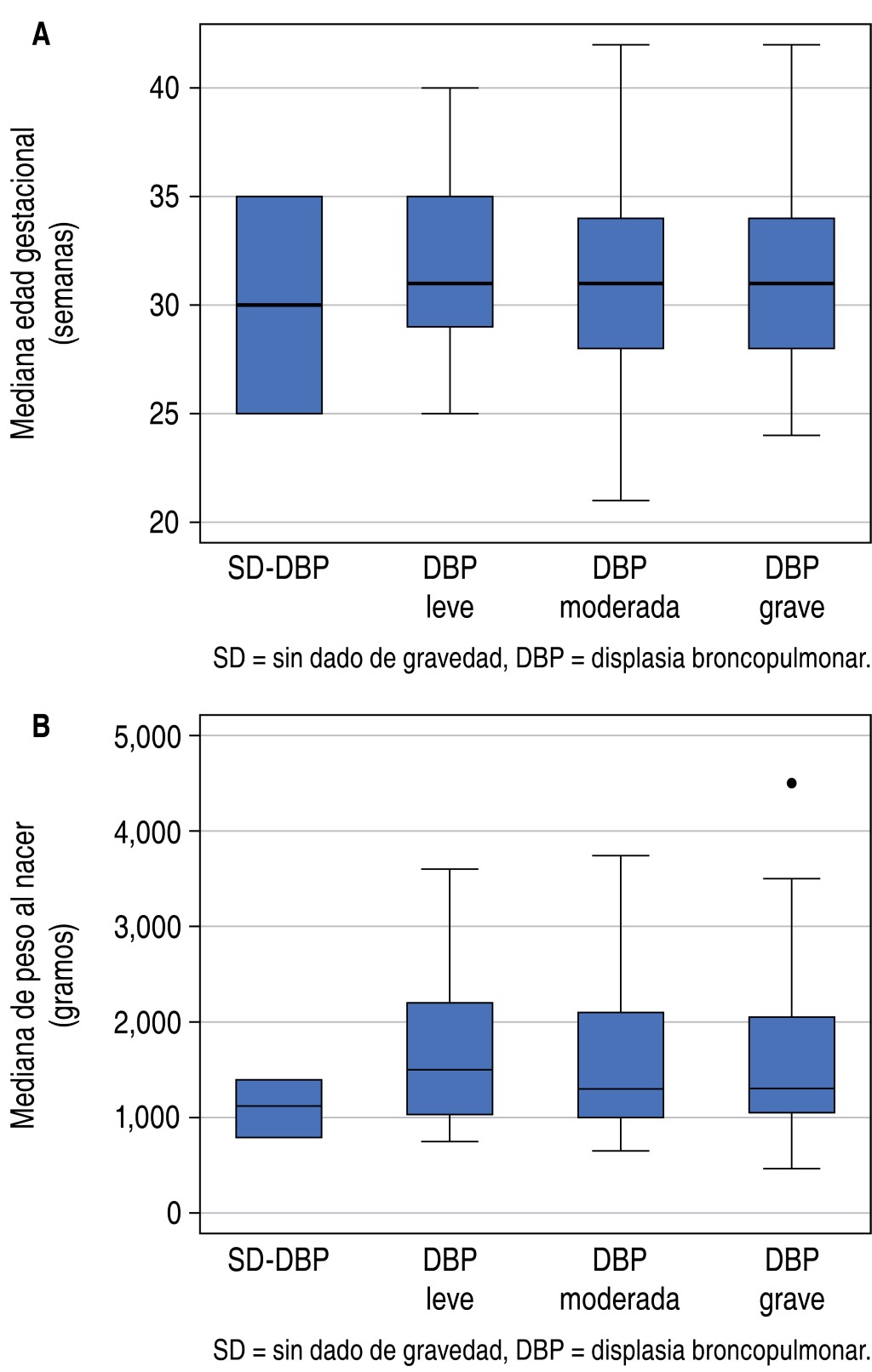
En las tres categorías de DBP, los más afectados fueron pacientes de sexo masculino (p = 0,153); la mediana de edad gestacional osciló entre 31 y 31,4 semanas, p = 0,450 (Figura 1A); y la mediana del peso al nacer fue de 1.500 g (rango: 1.030 a 2.200 g) en grupo de DBP leve; 1.300 g (rango: 1.000 a 2.100 g) en el grupo de DBP moderada y de 1.305 (rango: 1.050 a 2.050 g) en grupo de DBP grave (p = 0,775) (Figura 1B).
Las principales características de la población de estudio aparecen en la Tabla 2. El número de días de uso de oxígeno fue mayor en el grupo de DBP grave (180 días; rango: 96 a 370 días), comparado con el grupo de DBP leve (40 días; rango: 30 a 57 días), p = 0,001. En los grupos de DBP leve y moderada, la mayoría de pacientes (92,96 y 42,31%, respectivamente) usaron oxígeno por un periodo de tiempo más corto (menos de tres meses); mientras que en el grupo de DBP grave, 46,15% lo usaron por periodos mayores a seis meses.
La ventilación mecánica se empleó en grupos de DBP leve y moderada, por un tiempo menor a un mes, en comparación con el grupo de DBP grave, donde 71,54% lo usaron por un periodo cercano a dos meses. Específicamente el uso de ventilación mecánica fue de 12 días (rango: 6 a 22) para el grupo leve, de 20 días (rango: 10 a 30 días) para el moderado y de 54,2 días (IC95%: 49,23 a 59,33 días) para la grave, p = 0,000.
Sólo en 28,45% (n = 109) de la población se estableció el uso de surfactante, siendo su administración más alta en el grupo de DBP grave (33,08%). Por otro lado, al egreso hospitalario de la unidad de recién nacido, un alto número de pacientes con DBP moderada (64,84%) y grave (71,54%) usaban oxígeno, en comparación con el grupo de DBP leve (25,35%), p = 0,000.
El análisis de variables relacionadas con antecedentes del recién nacido evidenció que el bajo peso al nacer (9,97%), asfixia perinatal (25,39%), hemorragia intraventricular (19,69%) y la persistencia del conducto arterioso (PCA) (19,69%) fueron las más prevalentes siendo de mayor frecuencia en el grupo de DBP grave, sin que se encontraran diferencias entre grupos de DBP.
Las madres de pacientes con DBP en su mayoría (79,27%) tenían entre 20 y 39 años de edad con un grado de escolaridad principalmente de educación primaria (47,41%); sólo 3,37% (n = 13) tuvo embarazos múltiples, 26,68% (n = 103) presentó ruptura temprana de membranas y 15,54% (n = 60) sufrió hipertensión gestacional. El 73,63% (n = 282) tuvo parto por cesárea, pero no se encontró diferencia entre los grupos de DBP con respecto al parto vaginal (p = 0,876).
Antecedentes familiares de atopia (asma familiar) y ambientales (exposición a tabaquismo pasivo, humo de leña y zoonosis) también fueron evaluados, pero ninguno de ellos presentó diferencias entre los grupos de severidad de la DBP (Tabla 2).
Las comorbilidades más frecuentes fueron: alteración neurológica (19,69%) básicamente debida al retraso en el neurodesarrollo, parálisis cerebral y malformación del sistema nervioso central, entre otros; la alteración cardiaca (9,33%), diagnosticada por medio de ecocardiograma, incluyó principalmente PCA, comunicación interauricular, comunicación interventricular e hipertensión pulmonar (5,18%). La alteración neurológica y la hipertensión pulmonar fueron más frecuentes en el grupo de DBP severa, y mostró diferencias entre grupos de DBP (p = 0,034 y p = 0,037 respectivamente); las sibilancias recurrentes estuvieron presentes sólo en un 0,78% de la población.
La información de otras comorbilidades encontradas se detalla en la Tabla 2. A ninguno de los pacientes evaluados (n = 383) se le detectó la presencia de hernia diafragmática. El análisis por subgrupos de gravedad de DBP no mostró diferencias.
Se evaluó el número de hospitalizaciones y atenciones médicas recibidas en los dos primeros años de vida documentadas dentro del periodo de estudio, así como signos y síntomas que presentaron en la primera consulta de Neumología, 95,34% de los pacientes no tuvo o tuvo máximo tres hospitalizaciones, mientras que 4,66% tuvo entre cuatro y siete ingresos hospitalarios. Con relación al número de consultas, 89,38% de los pacientes tuvo entre una y 10 consultas por Neumología (mediana: 4 consultas; rango: 2 a 7 consultas), 8,81% entre 11 y 20 consultas y 1,81% entre 21 y 30 consultas y no se observaron diferencias entre los grupos de DBP (p = 0,707), los detalles por grupos de gravedad se pueden observar en la Tabla 3.
La edad promedio de la primera consulta con Neumología fue a los 6,69 meses (rango: 3,78 a 15,51 meses), no se observó una diferencia significativa con relación a la gravedad de DBP (p = 0,141).
El 69,17% de los pacientes fueron sintomáticos en la primera consulta (Tabla 3) y 26,94% usaban oxígeno, siendo la frecuencia de uso más alta a mayor gravedad de la DBP (p = 0,000). La radiografía de tórax fue ordenada en todos los pacientes en su primer control ambulatorio, y analizada en conjunto con el Servicio de Radiología, encontrando hallazgos compatibles con DBP tales como infiltrados intersticiales lineales, reticulares e hiperinsuflación en un total de 143 pacientes 37,05%; no se evidenciaron diferencias entre los grupos de gravedad (p = 0,353).
El uso de medicamentos como corticoide prenatal (18,60%), corticoide inhalado postnatal (80,31%), diuréticos (58,29%) y salbutamol (39,90%) hicieron parte del esquema terapéutico que recibieron estos pacientes. Todos los medicamentos tuvieron frecuencias de uso que se incrementaron gradualmente de acuerdo con la gravedad de la DBP, pero sólo el corticoide inhalado (p = 0,015) y el salbutamol (p = 0,014) mostraron diferencias entre grupos.
Discusión
El presente estudio, basado en información proveniente de una población pediátrica de pacientes derivados de la atención neonatal temprana en nuestra institución y de pacientes remitidos de hospitales externos, genera una gran diversidad en el grupo de población atendida, convirtiéndose en una buena opción para describir factores asociados al riesgo de sufrir DBP, así como comorbilidades propias de los niños con esta enfermedad.
Las formas moderada y severa de DPB fueron frecuentes en la población de estudio, especialmente en pacientes nacidos alrededor de la semana 31 y con bajo peso al nacer (1.500 g), coincidiendo con lo reportado en el estudio de D'Angio et al.26 quienes demostraron que bebés prematuros, pequeños para la edad gestacional o con restricción del crecimiento intrauterino tienen mayor riesgo de efectos adversos pulmonares y peores complicaciones.
Lum et al.27 refieren que niños con antecedente de DPB tienen un mayor riesgo de síntomas o enfermedades respiratorias en la infancia e hipoxemia crónica, debido a la disminución en el calibre de la vía respiratoria, disminución de los flujos y volúmenes espiratorios y una reducida capacidad de difusión que refleja una interrupción del desarrollo alveolar, disminución del área de superficie para el intercambio de gases y una angiogénesis interrumpida. Este trabajo encontró que el requerimiento de ventilación mecánica, el número de días de uso de oxígeno suplementario por tiempo prolongado, así como el uso de oxígeno al egreso hospitalario son factores que en nuestra población se ajustaron a los criterios diagnósticos de DBP, las cuales suelen ser intervenciones necesarias en las etapas más críticas de los neonatos y están claramente relacionadas con la patogénesis de la enfermedad, según lo describe el estudio de Tapia et al.28
La DBP fue más prevalente en pacientes del sexo masculino y en aquéllos que presentaron en la etapa neonatal factores de riesgo como presencia de hemorragia intraventricular, PCA y enterocolitis, mostrando un aumento relacionado con la gravedad de la DBP pese a que no fue estadísticamente significativa. Hay algunos factores que se han identificado frecuentemente en el desarrollo de la DBP, dentro de los que se encuentran la edad gestacional, el sexo masculino, y la PCA.
En contraste con el estudio de Cunha et al.29 respecto a las características de madres de pacientes con DBP, la preeclampsia no la encontramos como variable de interés; mientras que la ruptura prematura de membranas sí, al igual que el estudio de Cokyaman et al.30 La alta frecuencia de cesárea observada en nuestra investigación concuerda con lo reportado por Cunha et al.29 y nos permite inferir que estas mujeres probablemente tuvieron un diagnóstico precoz de las complicaciones maternas y fetales que pudieron llevarlas a un control más riguroso del embarazo y del parto, a pesar de su baja escolaridad. La edad materna, a diferencia de lo reportado por Klinger et al. no se relacionó con la presencia o gravedad de DBP en recién nacido con bajo peso al nacer.31
Según Cherian et al.,32 el oxígeno es la terapia más empleada durante la estancia de los casos en las unidades neonatales y juega un papel importante, dado que la hipoxia puede conducir a vasoconstricción pulmonar e hipertensión pulmonar, mientras que la hiperoxia puede conducir al desarrollo de DBP, retinopatía en el prematuro o lesión de la sustancia blanca cerebral; esta última lesión puede estar asociada al retraso del neurodesarrollo (característico de estos pacientes), denominado en nuestra publicación como alteración neurológica.
Las repercusiones a largo plazo comúnmente presentes son las alteraciones pulmonares crónicas que conllevan a hospitalizaciones frecuentes, generando hasta 49% de reingresos durante el primer año de vida.33 En nuestro estudio, durante los dos primeros años de vida, la gran mayoría de casos requirieron al menos tres hospitalizaciones, entre una y 10 consultas por Neumología e inicio de su primera atención por nuestro servicio alrededor de los seis meses de edad.
Otras alteraciones que se han identificado frecuentemente en el desarrollo de la DBP son anomalías persistentes del desarrollo de la función pulmonar con presencia de tos crónica, sibilancias y uso de medicamentos broncodilatadores, con una alta incidencia de asma a los cinco años.33-35 En nuestro estudio, aunque la tos y las sibilancias fueron documentadas, no se encontró una alta frecuencia en los pacientes atendidos en consulta, pero el uso de broncodilatadores sí tuvo una frecuencia importante siendo significativa su formulación en los pacientes con DBP.
Los corticoides inhalados se emplearon en nuestro estudio con una alta frecuencia y logramos demostrar que su uso para manejo de la DPB es de gran utilidad. Lo anterior está alineado con lo reportado por el estudio neurosis, un ensayo doble ciego controlado con placebo realizado en 40 centros en nueve países europeos que midió el efecto de los corticoides inhalados a largo plazo en 863 recién nacidos prematuros de 23 a 27 semanas, encontrando que la incidencia de DBP fue de 27,8% comparado con 38% en los que no recibieron esta terapia, además demostró que a largo plazo no hubo discapacidad del desarrollo neurológico, sordera o ceguera,36,37 por lo que recomiendan su uso, dada su actividad antiinflamatoria y menores efectos secundarios que los esteroides sistémicos.36
En general, los datos obtenidos muestran frecuencias similares en las variables maternas y del recién nacido reportadas por el estudio de Maya-Barrios et al.33 realizado en población mexicana de neonatos.
Una de las limitaciones del estudio dado su carácter retrospectivo fue el no poder realizar estimación estadística confiable de variables de importancia en pacientes con DBP, como lo son el uso de surfactante y la presencia de comorbilidad gastrointestinal. Lo anterior debido a que no fue posible establecer con seguridad en la totalidad de la población el uso de surfactante y la realización de pruebas para confirmar la presencia de reflujo gastroesofágico y/o alteración en la mecánica de la deglución, los cuales son parte de las alteraciones gastrointestinales. Lo anterior puede ser debido a un subregistro en las historias clínicas.
La meta con estos pacientes ha sido lograr egresos cada vez más rápidos para que se incorporen lo más pronto posible a un seguimiento ambulatorio adecuado que incluya manejo por parte de un equipo multidisciplinario que lleve a la prevención de enfermedades respiratorias, a lograr un retiro del oxígeno domiciliario de manera temprana y a un seguimiento nutricional, cardiovascular y de neurodesarrollo adecuados, por lo cual venimos trabajando institucionalmente en la constitución de la clínica de DBP con el apoyo de diferentes servicios.
Conclusiones
La población de pacientes con DBP que fue parte de este estudio se caracterizó por tener principalmente una enfermedad grave y moderada que requirió uso prolongado de ventilación mecánica y de terapia con oxígeno. No se encontraron antecedentes maternos, del recién nacido, ni factores ambientales asociados estadísticamente a la gravedad de la DPB. Las alteraciones neurológicas y la hipertensión pulmonar fueron complicaciones significativas en nuestra población. A pesar de la severidad de la DBP, no hubo un alto requerimiento de hospitalizaciones, logrando seguimientos ambulatorios a través de la consulta externa en el Servicio de Neumología, donde el uso de corticosteroide inhalado mostró ser de gran utilidad.
Agradecimientos
Horacio Márquez González, por su asesoría en el diseño del estudio y Sandra Johanna Echeverry Coral por el análisis estadístico y la asesoría metodológica.
AFILIACIONES
1Hospital Infantil de México "Federico Gómez", Ciudad de México, México.Conflicto de intereses: Los autores declaramos no tener ningún conflicto de intereses con respecto a la investigación, autoría o publicación. Los autores no hemos recibido fondos o beneficios de la industria o en otros lugares para llevar a cabo este estudio.
REFERENCIAS
Baud O, Maury L, Lebail F, Ramful D, El Moussawi F, Nicaise C, et al. Effect of early low-dose hydrocortisone on survival without bronchopulmonary dysplasia in extremely preterm infants (PREMILOC): a double-blind, placebo-controlled, multicentre, randomised trial. Lancet [Internet]. 2016 Apr 30 [cited 2021 Dec 23];387(10030):1827-1836. Available in: https://linkinghub.elsevier.com/retrieve/pii/S0140673616002026
Instituto Mexicano del Seguro Social. Prevención, Diagnóstico y Tratamiento de la Displasia Broncopulmonar en niñas/niños menores de 2 años en el segundo y tercer nivel de atención. [Internet]. Catálogo Maestro de Guías de Práctica Clínica: 2015. p. IMSS-776-15. Available in: http://www.cenetec-difusion.com/CMGPC/IMSS-776-15/ER.pdf
D'Angio CT, Ambalavanan N, Carlo WA, McDonald SA, Skogstrand K, Hougaard DM, et al. Blood cytokine profiles associated with distinct patterns of bronchopulmonary dysplasia among extremely low birth weight infants. J Pediatr [Internet]. 2016;174:45-51.e5. Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2982806/pdf/nihms248679.pdf
Tapia JL, Agost D, Alegria A, Standen J, Escobar M, Grandi C, et al. Bronchopulmonary dysplasia: Incidence, risk factors and resource utilization in a population of South American very low birth weight infants. J Pediatr (Rio J). 2006;82(1):15-20. Available in: http://www.jped.com.br/ArtigoDetalhe.aspx?varArtigo=1431&idioma=pt-BR
Giubergia V, Bauer G, Rentería F, González H, Vila F, Giubergia V, Michelini A, Aguerre V, et al. Seguimiento neumológico de los niños con displasia broncopulmonar al alta de la Unidad de Cuidados Intensivos Neonatal Parte 1: Epidemiología, fisiopatología y clínica. Arch Argent Pediatr. 2013;111(2):165-172.
|
Tabla 1: Clasificación de la displasia broncopulmonar. |
||
|
Edad gestacional al nacer |
< 32 semanas |
> 32 semanas |
|
Momento de la evaluación |
36 semanas de edad postconcepcional o egreso hospitalario (lo que ocurra primero) |
Más de 28 días pero menos de 56 días de edad postnatal o egreso hospitalario (lo que ocurra primero) |
|
Tratamiento con oxígeno |
Más de 21% durante 28 días o más |
|
|
DBP leve |
Respira aire ambiente a las 36 semanas de edad postconcepcional o al alta (lo que ocurra primero) |
Respira aire ambiente al día 56 de edad postnatal o al alta (lo que ocurra primero) |
|
DBP moderada |
Recibe oxígeno suplementario con FiO2 2 < 30% a las 36 semanas de edad postconcepcional o al alta (lo que ocurra primero) |
Recibe oxígeno suplementario con FiO2 < 30% al día 56 de edad postnatal o al alta (lo que ocurra primero) |
|
DBP grave |
Recibe oxígeno suplementario con FiO2 ≥ 30% y/o CPAP o VM a las 36 semanas de edad postconcepcional o al alta (lo que ocurra primero) |
Recibe oxígeno suplementario con FiO2 ≥ 30% y/o CPAP o VM al día 56 de edad postnatal o al alta (lo que ocurra primero) |
|
CPAP = presión positiva continua en las vías respiratorias, DBP = displasia broncopulmonar, FiO2 = fracción inspirada de oxígeno, VM = ventilación mecánica. Adaptado de: Jobe A, et al.3 |
||
|
Tabla 2: Características principales de la población de estudio. |
|||||
|
Variables |
Gravedad DPB |
||||
|
DE 3 |
Leve n (%) 71 (18,39) |
Moderada n (%) 182 (47,15) |
Grave n (%) 130 (33,68) |
p
NA |
|
|
Variables prenatales |
|||||
|
Sexo Femenino Masculino |
1 |
26 (36,62) 44 (61,97) |
79 (43,41) 103 (56,59) |
55 (42,31) 75 (57,69) |
0,153 |
|
Edad gestacional Mediana (semanas) Rango |
|
31,0 29-35 |
31,4 28-34 |
31,2 28-34 |
0,861 |
|
Peso al nacer Mediana (g) Rango |
|
1.500 1.030-2.200 |
1.300 1.000-2.100 |
1.305 1.050-2.050 |
0,597 |
|
Días con O2 Mediana (días) Rango |
|
40 30-57 |
107 63-210 |
180 96-370 |
0,001* |
|
Días ventilación mecánica Mediana (días) Rango |
36 |
12 6-22 |
20 10-30 |
54 49-59 |
0,001* |
|
Surfactante Sí |
|
17 (23,94) |
49 (26,92) |
43 (33,08) |
NC |
|
Egreso con O2 Sí |
|
18 (25,35) |
118 (64,84) |
93 (71,54) |
0,000* |
|
Antecedentes prenatales |
|||||
|
Corioamnioitis Sí |
|
0 (0) |
3 (1,65) |
2 (1,54) |
0,717 |
|
Hemorragia intraventricular Sí |
|
9 (12,68) |
31 (17,03) |
27 (20,77) |
0,344 |
|
Ductus arterioso persistente Sí |
|
10 (14,08) |
33 (18,13) |
33 (25,38) |
0,115 |
|
Enterocolitis Sí |
|
4 (5,63) |
20 (10,99) |
13 (10,00) |
0,466 |
|
Asfixia perinatal Sí |
|
17 (23,94) |
44 (24,18) |
37 (28,46) |
0,577 |
|
Desnutrición al nacimiento Sí |
|
66 (92,96) |
165 (90,66) |
122 (93,85) |
0,285 |
|
Antecedentes maternos |
|||||
|
Edad materna (años) < 20 20-39 > 40 |
|
10 (14,08) 58 (81,69) 3 (4,23) |
28 (15,38) 141 (77,47) 13 (7,14) |
13 (10) 106 (81,54) 11 (8,46) |
0,574 |
|
Escolaridad materna Primaria Secundaria Técnico Universitaria No lee ni escribe |
|
31 (43,66) 28 (39,44) 2 (3) 7 (10) 3 (4) |
94 (51,65) 68 (37,36) 4 (2) 16 (9) 0,00 (0,00) |
57 (43,85) 52 (40,00) 4 (3,08) 14 (10,8) 3 (2,31) |
0,39 |
|
Variables maternos |
|||||
|
Cesárea Sí |
|
54 (76,06) |
133 (73,08) |
95 (73,08) |
0,876 |
|
Embarazo múltiple Sí |
|
3 (4,23) |
5 (2,75) |
5 (3,85) |
0,807 |
|
Ruptura prematura de membranas Sí |
|
19 (26,76) |
44 (24,18) |
40 (30,77) |
0,432 |
|
Hipertensión gestacional Sí |
|
12 (16,9) |
29 (15,93) |
19 (14,62) |
0,905 |
|
Antecedentes familiares y ambientales |
|||||
|
Tabaquismo pasivo Sí |
|
10 (14,08) |
26 (14,29) |
12 (9,23) |
0,493 |
|
Zoonosis Sí |
|
22 (30,99) |
48 (26,37) |
26 (20,00) |
0,338 |
|
Humo de leña Sí |
|
4 (5,63) |
4 (2,2) |
4 (3,08) |
0,393 |
|
Historia familiar de asma Sí |
|
5 (7,04) |
7 (3,85) |
9 (6,92) |
0,462 |
|
* Estadísticamente significativo. DBP = displasia broncopulmonar. |
|||||
|
Tabla 3: Características de las atenciones médicas. |
|||||
|
Variables |
Gravedad DPB |
p |
|||
|
DE 3 |
Leve n (%) 71 (18,39) |
Moderada n (%) 182 (47,15) |
Grave n (%) 130 (33,68) |
||
|
Atenciones médicas recibidas |
|||||
|
Hospitalizaciones causa respiratoria 0 a 3 4 a 7 |
|
68 (95,77) 3 (4,23) |
177 (97,25) 5 (2,75) |
120 (92,31) 10 (7,69) |
0,140 |
|
Número de consultas en neumología |
|||||
|
Mediana y rango Rango 0 a 10 11 a 20 21 a 30 |
|
5 (2 a 7) 61 (85,92) 8 (11,27) 2 (2,82) |
4 (2 a 7) 164 (90,11) 16 (8,79) 2 (1,10) |
5 (2 a 7) 118 (90,77) 10 (7,69) 2 (1,54) |
0,489
0,707 |
|
Características primera consulta por neumología |
|||||
|
Edad Mediana (meses) Rango |
26 |
5,95 2,84 a 12,72 |
6,27 3,22 a 15,35 |
6,88 4,60 a 15,61 |
0,141 |
|
Peso Mediana (kg) Rango |
19 |
5,0 3,5 a 8,0 |
4,8 3,5 a 7,2 |
4,7 3,29 a 7,1 |
0,446 |
|
Talla Mediana (cm) Rango |
20 |
60 53 a 71 |
59 52 a 72 |
57 51 a 70 |
0,590 |
|
Obstrucción nasal Sí |
|
3 (4,23) |
10 (5,49) |
4 (3,08) |
0,641 |
|
Saturación de O2 Mediana (%) Rango |
19 |
94 93 a 95 |
93 91 a 95 |
93 92 a 96 |
0,269 |
|
Rinorrea Sí |
|
3 (4,23) |
15 (8,24) |
9 (6,92) |
0,604 |
|
Sibilancias Sí |
|
3 (4,23) |
5 (2,75) |
8 (6,15) |
0,305 |
|
Tiraje Sí |
|
1 (1,41) |
5 (2,75) |
7 (5,38) |
0,315 |
|
Tos Sí |
|
14 (19,72) |
32 (17,58) |
30 (23,08) |
0,493 |
|
Usa O2 Sí |
|
9 (12,68) |
45 (24,73) |
49 (37,69) |
0,000* |
|
Cianosis Sí |
|
2 (2,82) |
4 (2,20) |
5 (3,85) |
0,668 |
|
Crépitos Sí |
|
4 (5,63) |
7 (3,85) |
10 (7,69) |
0,330 |
|
Disnea Sí |
|
4 (5,63) |
3 (1,65) |
7 (5,38) |
0,115 |
|
* Estadísticamente significativo. DBP = displasia broncopulmonar. |
|||||


