¿Los neutrófilos como células de defensa? Inmunobiología y fisiopatología en las enfermedades infecciosas respiratorias humanas
Rojas-Valles, Edwin U1,2,4; Magaña-González, Carlos Alberto3,4; Herrera-Barrios, María Teresa2
Rojas-Valles, Edwin U1,2,4; Magaña-González, Carlos Alberto3,4; Herrera-Barrios, María Teresa2
RESUMEN
El sistema inmunológico nos protege de las infecciones y la entrada de cualquier patógeno activa la inmunidad innata. Los neutrófilos son parte de este tipo de respuesta y son los más abundantes en la sangre con una vida media corta que se incrementa cuando están activados. Se generan en la médula ósea durante la granulopoyesis y su liberación a la sangre depende de la unión de CXCR4-CXCL12. Son las primeras células en llegar al sitio de infección o inflamación, y sus mecanismos bactericidas son la fagocitosis, la desgranulación, la producción de especies reactivas de oxígeno, trampas extracelulares de neutrófilos, citocinas y quimiocinas. Durante las infecciones, llevan a cabo la fagocitosis caracterizada por la fusión directa fagosoma-gránulo, y los patógenos mueren por la acción de proteínas granulares tóxicas y moléculas oxidantes (especies reactivas de oxígeno y ácido hipocloroso). Los patógenos o citocinas favorecen la desgranulación que, junto con la producción de especies reactivas de oxígeno y ácido hipocloroso, actúan sobre las proteínas, ADN y las membranas bacterianas favoreciendo su eliminación. Los neutrófilos producen trampas extracelulares de neutrófilos para atrapar los patógenos y evitar su propagación y, además, son fuente de citocinas y quimiocinas, por lo que participan en la regulación de la respuesta inmune. En las enfermedades infecciosas humanas su participación puede ayudar, o contribuir a un mal pronóstico, provocando daño tisular. Esta revisión tiene como objetivo conocer las generalidades de los neutrófilos y su participación en enfermedades respiratorias humanas como COVID-19, influenza, tuberculosis e histoplasmosis.PALABRAS CLAVE
neutrófilos, COVID-19, influenza, tuberculosis, histoplasmosis.Abreviaturas:
Introducción
El sistema inmune incluye células que participan en la inmunidad innata o en la inmunidad adquirida para mantener la homeostasis corporal. La entrada de cualquier patógeno desencadena una respuesta innata que es rápida para eliminar el patógeno y prevenir la enfermedad. Esta es mediada por el reconocimiento de patrones moleculares asociados a patógenos y patrones moleculares asociados a daño celular sin generar memoria inmunológica. Los neutrófilos forman parte de esta respuesta y sus mecanismos bactericidas son la fagocitosis, la degranulación, la producción de especies reactivas de oxígeno (ROS, Reactive Oxygen Species), trampas extracelulares de neutrófilos (NET, Neutrophils Extracellular Tramps), citocinas y quimiocinas.
1. Neutrófilos
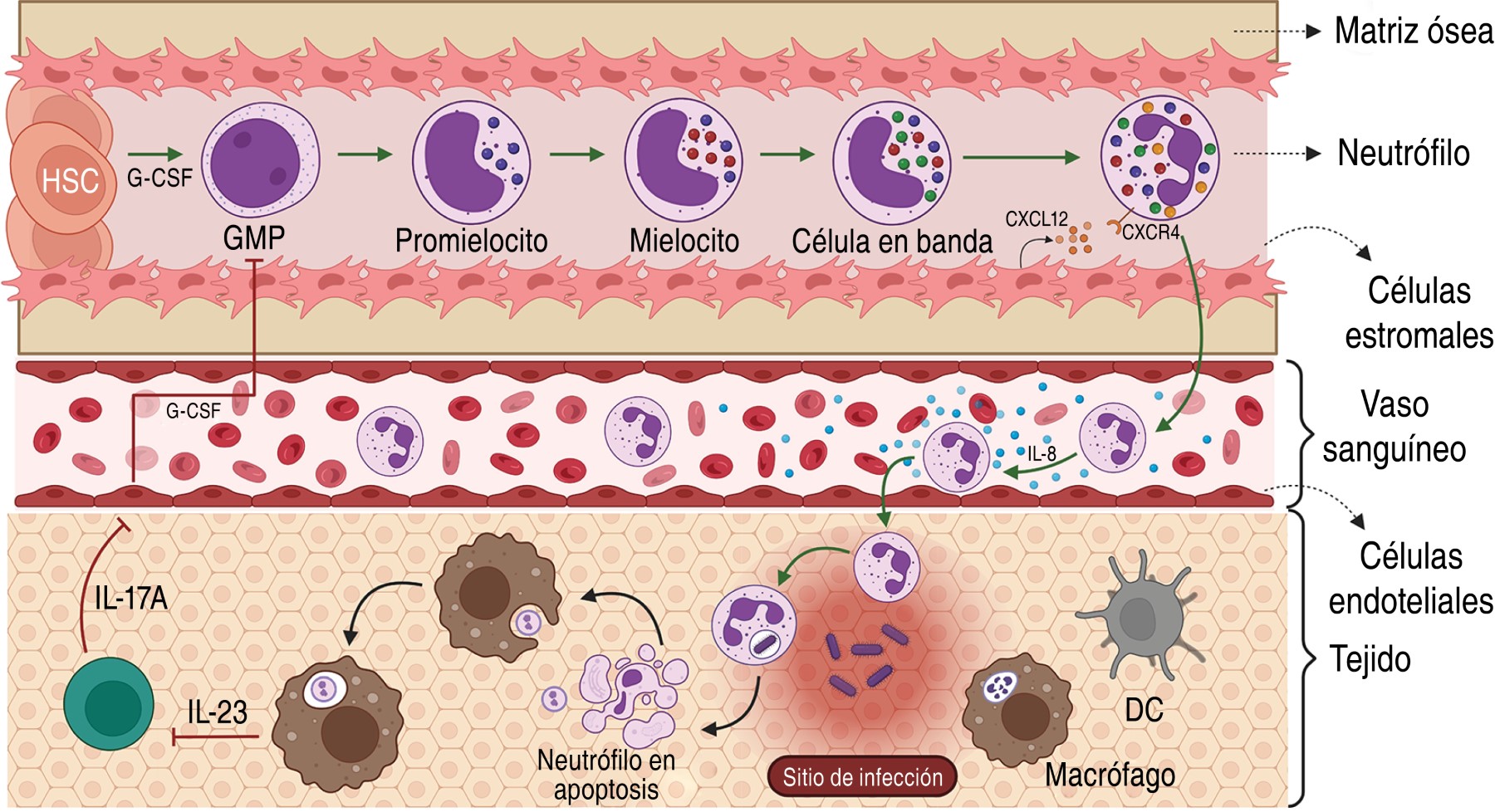
1.1 Origen y características: se generan en la médula ósea por granulopoyesis a partir de un precursor mieloide y se ha estimado que un adulto sano produce 1-2 × 1011. Las células madre hematopoyéticas se localizan en los espacios creados por los osteoblastos y células endoteliales caracterizados por flujo bajo de sangre y menor tensión de oxígeno, mientras que las células más maduras y con mayor división celular están cerca del lado abluminal de los sinusoides, una estructura vascular especial de la médula ósea.1 Terminada la maduración, los neutrófilos son liberados a la sangre y este proceso depende de la interacción de su receptor de quimiocina CXCR4 y la quimiocina CXCL12 producida por las células estromales en la médula ósea.2
Su homeostasis es regulada por la fagocitosis de los neutrófilos apoptóticos por los macrófagos y células dendríticas en los tejidos, reduciendo su proliferación de una manera dependiente del eje IL-23/IL-17A/G-CSF.3 La fagocitosis disminuye la producción de la interleucina 23 (IL-23), causando la disminución en la producción de IL-17A por los linfocitos T reguladores de neutrófilos o Th17 (Tn/Th17), que se localizan en los nódulos linfoides mesentéricos.4 En consecuencia, Los niveles bajos de IL-17A, disminuyen la producción del factor estimulante de granulocitos (G-CSF, Granulocyte Stimulated Factor) por los fibroblastos y células endoteliales reduciendo la producción de neutrófilos maduros. Por otra parte, la inflamación o infección ocasionan el aumento del G-CSF favoreciendo la granulopoyesis, producción y reclutamiento de los neutrófilos.2,5 Además, la homestoasis de los neutrófilos involucra su muerte celular por necrosis, necroptosis, NETosis y piroptosis (Figura 1).6,7
Constituyen 50-70% de los leucocitos en circulación, con un diámetro de 7-10 μm, un núcleo segmentado, con alto contenido de gránulos y presencia de vesículas de secreción en su citoplasma.2,5 Su vida media es de ocho a 20 horas sin estímulo, aunque después de su migración a los tejidos se prolonga de 1-4 días.6
Reconocen a los patógenos a través de sus receptores en membrana como: receptores scavenger, de manosa, Dectina 1, CD14, FcγR, CiqR, CR1, CR3, colectinas, receptores tipo Toll, receptores tipo NOD.7
Sus gránulos citoplasmáticos son clasificados en: Gránulos primarios/azurófilos, que contienen mieloperoxidasa (MPO), serina proteasas, elastasa de neutrófilos (NE, neutrophil elastase), proteinasa 3, catepsina G, azurocidina, α-defensinas (HNP-1, HNP-2, y HNP-3), serprocidinas y la BPi (BPi, Bactericidal-permeability-increasing protein). Gránulos secundarios/específicos, que contienen MMP8 (MMP8, matriz metaloproteinasa 8), lactoferrina, LL-37, lipocalina 2, haptoglobina, Pentraxina 3 y olfactomedina 4. Gránulos terciarios/gelatinasa contienen gelatinasa B, MMP8, MMP9, Arginasa-1, LL-37 y lisozima, y las vesículas secretoras que contienen albúmina, citocinas, receptores de membrana (CR1, CR3, C1qR, FcγR, CD14, FPR1), moléculas de adhesión celular (CD11b/CD18, CD67) y parte del complejo nicotinamide adenine dinucleotide phosphate oxidase (NADPH). Las proteínas de los gránulos se adquieren durante la granulopoyesis.2,5,8,9
2. Mecanismos bactericidas
2.1 Fagocitosis: es un proceso de ingestión y eliminación de partículas o patógenos que ingresan al organismo mayores a 0.5 μm, incluyendo los cuerpos apoptóticos.10,11 Los neutrófilos, macrófagos, monocitos y células dendríticas son clasificados como fagocitos profesionales, ya que realizan esta labor con gran eficiencia,10 mientras que los fibroblastos, las células epiteliales y endoteliales son considerados fagocitos no profesionales encargados de eliminar las células muertas para mantener la homeostasis.10,11
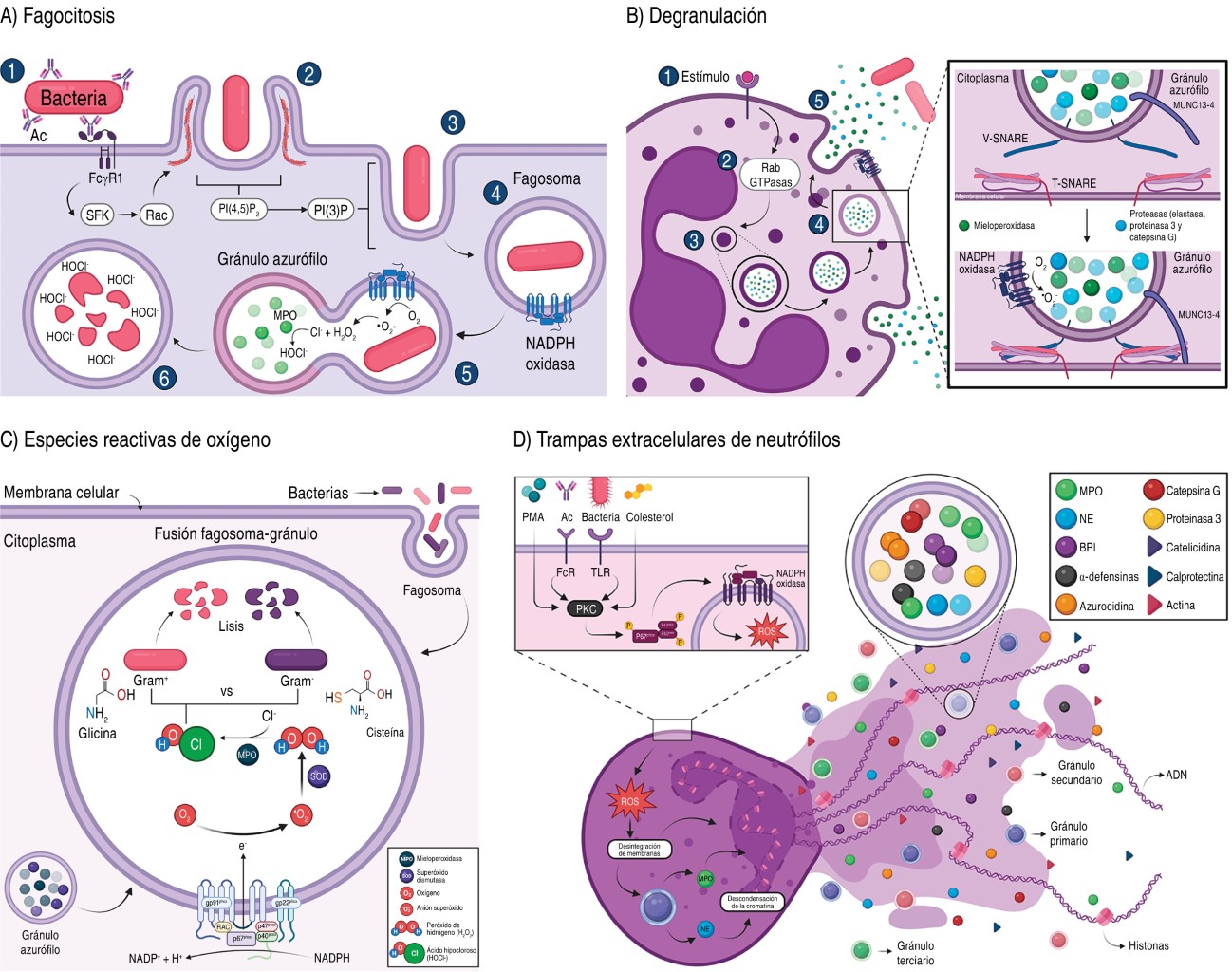
Se inicia con la unión del ligando a los receptores fagocíticos, que se dividen en opsónicos como: receptores del fragmento cristalizable de la IgG (FcγR) y del complemento (CiqR, CR1, CR3); y los no opsónicos como: receptores de manosa, Dectina 1, CD14, colectinas, TLRs, lectina tipo C y receptores scavenger.10,12 En comparación con los macrófagos, la fagocitosis por los neutrófilos es rápida al fusionarse directamente el fagosoma con los gránulos citoplasmáticos en menos de 60 segundos, permitiendo la eliminación rápida de los patógenos (Figura 2A).13,14
La unión del patógeno o partícula causa una respuesta rápida oxidativa y no oxidativa por el ensamblaje del complejo NADPH oxidasa en la membrana del fagosoma.9
2.2 Degranulación: estas células también combaten a los patógenos extracelulares al liberar sus gránulos citoplasmáticos. Se requieren de dos tipos de señales: a) la dependiente de integrinas β2; y b) la activación de receptores como Mac1/CR3, FcγR y G Protein-Coupled Receptors (GPCR). En este proceso participan las proteínas Rab y Soluble N-ethylmaleimide-sensitive factor attachment protein receptor (SNARE) involucradas en el control del tráfico vesicular (Figura 2B).
La degranulación de las vesículas secretoras y gránulos terciarios es rápida; sin embargo, los gránulos primarios requieren de neutrófilos preactivados con citocinas proinflamatorias, quimiocinas o componentes microbianos. Los neutrófilos previenen la degranulación excesiva de gránulos terciarios al incrementar la producción de ROS, ya que el proceso desregulado puede causar daño tisular.2
La fagocitosis y la degranulación causan el ensamblaje del complejo de la NADPH oxidasa en la membrana, causando la producción de ROS.9,15
2.3 Producción de especies reactivas de oxígeno (ROS): la interacción de los neutrófilos con el patógeno desencadena el estallido oxidativo que involucra el sistema enzimático NADPH oxidasa-NOX2, que se ensambla en la membrana celular y se generan dos moléculas de •O2- y la enzima superóxido dismutasa genera H2O2 que actúa como antimicrobiano al reaccionar con los grupos tiol de las enzimas, proteínas, ADN y membranas bacterianas.11,16-18
Además, la MPO utiliza H2O2 y cataliza la reacción con los iones de cloruro, formando un ácido hipocloroso (HOCl-) sumamente reactivo con los grupos tiol y los residuos de metionina (Figura 2C).11,19
Es importante mencionar que algunos patógenos han generado una defensa contra las ROS, pero los neutrófilos poseen otros mecanismos bactericidas alternos.20
2.4 Producción de trampas extracelulares de neutrófilos (NET): los neutrófilos mueren por NETosis donde se generan las NET, que son fibras extracelulares compuestas de ADN, proteínas citosólicas y gránulos antimicrobianos, que atrapan, neutralizan y eliminan a los patógenos. Este proceso se inicia con la pérdida de la forma lobulada del núcleo y desensamble de la membrana nuclear, pérdida de la permeabilidad de las membranas granulares, inactivación de las histonas por acción de la NE que degrada la histona central H1 (Histona 1) provocando la descondensación de la cromatina; causando que la mezcla de la cromatina en el citosol con los componentes citosólicos y granulares, asi como la pérdida de la permeabilidad de la membrana celular que permite la liberación de las NET al espacio extracelular (Figura 2D).15,21,22
Se ha reportado que las proteínas identificadas en las NET pueden variar dependiendo del estímulo, ya que con el estímulo Fitohemaglutinina (PMA, Phorbol-Myristate-Acetate) se identificaron 24 proteínas, y con Pseudomonas aeruginosa 80 proteínas;15,21 aunque siempre se encuentran las histonas, NE, MPO, calprotectina, catelicidinas, α-defensinas y actina.21
Las NET se forman por dos vías: a) dependiente de NADPH oxidasa (lítica, más estudiada) que es activada por anticuerpos, microorganismos, colesterol y mitógenos (PMA, concanavalina A).23,24 Los estímulos activan la proteína cinasa C (PKC, Protein kinase C), que activa el ensamblaje de la NADPH oxidasa a la membrana, iniciando la producción de las ROS, que desintegran las membranas del núcleo y los gránulos, permitiendo que la NE y MPO interactúen con las histonas para facilitar la descondensación de la cromatina.23,24
Por otro lado, en la b) independiente de NADPH oxidasa (no lítica, menos estudiada) el núcleo se condensa y las membranas nucleares se separan formando vesículas con ADN que se expulsan al medio extracelular liberando la cromatina.25 Este mecanismo evita la diseminación de los patógenos, aunque también tiene propiedades bactericidas directas. Por ejemplo, la NE actúa sobre las proteínas de la membrana externa y los factores de virulencia de las enterobacterias.15 La presencia de NET está involucrada en trastornos inflamatorios y autoinmunes, como el síndrome de dificultad respiratoria aguda, trombosis en la COVID-19, y en artritis reumatoide.22
2.5 Producción de citocinas y quimiocinas: los neutrófilos son fuente de citocinas y quimiocinas para interactuar con linfocitos T, linfocitos B, macrófagos y células dendríticas; participando en la regulación de la inmunidad innata y adquirida.26 Producen citocinas pro- y antiinflamatorias, inmunorreguladoras, G-CSF; y quimiocinas de tipo CXC importantes en la migración celular hacia el tejido y viceversa (Tabla 1).27-34
3. Neutrófilos en enfermedades infecciosas
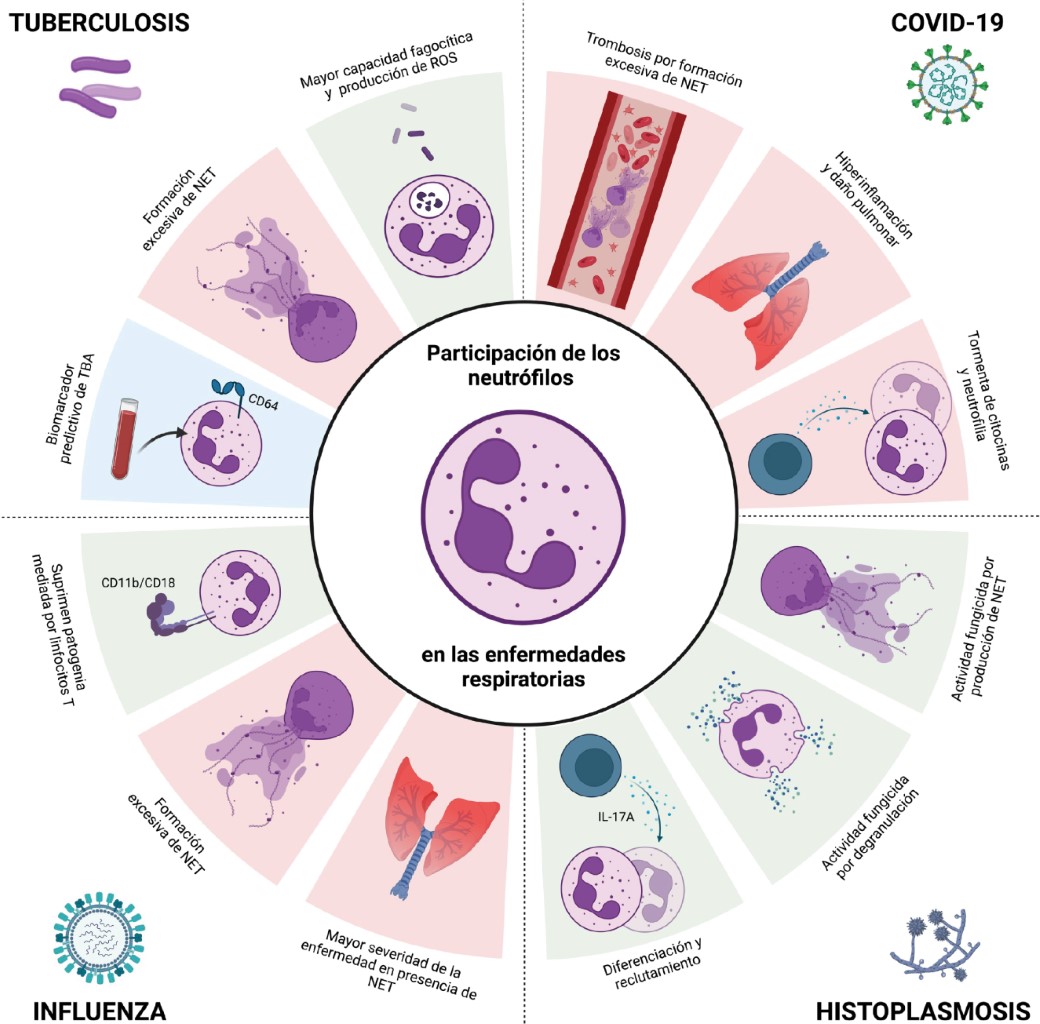
3.1 COVID-19: en diciembre de 2019, se propagó en Wuhan, China una nueva forma de coronavirus denominada SARS-CoV-2 (coronavirus del síndrome respiratorio agudo severo 2), un virus de ARN monocatenario, envuelto de sentido positivo que pertenece a los β-coronavirus. La Organización Mundial de la Salud (OMS) declaró la pandemia el 11 de marzo de 2020.35 Hasta el 16 de noviembre de 2023, se confirmaron 772,011,164 casos y 6,979,786 muertes en el mundo.36 En pacientes con COVID-19, se ha evidenciado la presencia de la NE, MPO, histona H3 citrulinada (Cit-H3), NET y plaquetas que se han relacionado con la oclusión vascular, la necroinflamación y el estrés oxidativo.37
En la forma severa de COVID-19 se ha descrito la inflamación y la "tormenta de citocinas" (IL-1β, IL-2, IL-6, IL-7, IL-8, IL-10, IL-17, TNF, IFN-γ, IP-10, GM-CSF, MCP-1 e IL-10) que llevan al desarrollo del síndrome del estrés respiratorio agudo.38,39 Se ha descrito el reclutamiento de neutrófilos al sitio de infección y la formación de NET que contribuyen con la formación de trombos y la dificultad respiratoria (Figura 3).39
La relación neutrófilo-linfocito (NLR, neutrófilo/linfocito) basada en la cantidad de neutrófilos y linfocitos en la sangre junto con la relación neutrófilos-albúmina (NAR) se han considerado como biomarcadores de infección e inflamación sistémica. Los valores de NLR son útiles para el pronóstico, ya que valores menores a 3 indican inflamación sistémica leve, de 3 a 5 inflamación moderada, y mayor a 5 son indicativos de inflamación severa,40 siendo el síndrome de insuficiencia respiratoria aguda la causa primaria de muerte en los pacientes COVID-19. En conjunto, la neutrofilia, NLR y NAR en las etapas tempranas de la infección se correlacionan con la severidad de la infección.41
En la forma grave de COVID-19 hay neutrofilia en sangre y en el tejido pulmonar con aumento de IL-1β, IL-6 y dímero D; mientras que las NET tienen el potencial de propagar la inflamación, la trombosis microvascular y la tormenta de citocinas en los pulmones.42,43
En la oclusión vascular la NLR, la MCP-3 (proteína 3 quimiotáctica de monocitos) e IL-8 favorecen la neutrofilia en pacientes con COVID-19 leve y grave, formándose agregados de neutrófilos y trombocitos que se dirigen principalmente a los vasos pulmonares,44 los complejos de plaquetas-fibrina se dirigen a las pequeñas arterias pulmonares y los trombos a los capilares pulmonares.42 Los neutrófilos y las NET favorecen la necroinflamación,45 por la infiltración de agregados de las NET que forman trombos en los vasos pulmonares, induciendo vasculitis y finalmente la necrosis que favorece la tormenta de citocinas, causando más inflamación.46
Dentro de las complicaciones críticas del COVID-19 está la trombosis que ha sido asociada a niveles elevados de ADN libre, cit-H3, complejo MPO-ADN y NET identificadas en microtrombos arteriolares. El ADN, NE, MPO y catepsina G liberadas tienen efectos citotóxicos en el epitelio pulmonar y células endoteliales (Tabla 2).
Se han descrito marcadores potenciales de NET asociados a síntomas, por ejemplo: niveles elevados de ADN, citH3, NE y el complejo MPO-ADN están asociados a admisión a terapia intensiva, ventilación mecánica y mortalidad a corto plazo. El complejo MPO-ADN se ha asociado a insuficiencia orgánica secuencial, NE e Histona-ADN asociado a daño pulmonar, falla renal, temperatura corporal y MPO asociada a días con hipoxia severa.41 La liberación de las NET y ROS causa desequilibrio entre la producción de ROS y los mecanismos antioxidantes, aumentando la lesión tisular.47
3.2 Influenza: causada por virus del género Influenzavirus, pertenecientes a la familia Orthomyxoviridae, en la que se encuentra el virus de ARN monocateriano de sentido negativo, que se transmiten por aerosoles afectando a las células del tracto respiratorio y a los neumocitos tipo II.48,49 Las epidemias anuales causan de 3 a 5 millones de casos graves y de 290,000 a 650,000 muertes.50
Los virus de influenza A, B y C afectan a los humanos, pero sólo A y B son de importancia médica.49,51 El virus de la influenza tipo A (VIA) es el más común y tiene diversos subtipos, que se clasifican de acuerdo con su variación antigénica en sus proteínas de superficie: hemaglutinina y neuraminidasa.49
Causa epidemias estacionales y se manifiestan como una enfermedad aguda con síntomas de leves a severos; sin embargo, puede complicarse llevando a hospitalización o la muerte.48,49 Las complicaciones afectan a grupos de riesgo (niños o adultos mayores) y con comorbilidades (enfermedades pulmonares o cardíacas crónicas, diabetes mellitus e inmunosupresión).48
Los neutrófilos contribuyen al control de la enfermedad, y en la infección con VIA en el modelo murino, los neutrófilos y sus moléculas de adhesión (CD11b/CD18) son importantes al limitar la patología mediada por linfocitos T.52 Sin embargo, aunque el virus induce una respuesta inmune innata caracterizada por infiltrado de neutrófilos en los pulmones y mecanismos que promueven la resolución de la infección, también contribuyen a la patología de la enfermedad grave.53 A pesar del daño tisular, la falta de neutrófilos está asociada a mayor daño pulmonar.53,54
En pacientes con influenza, los neutrófilos y las NET están asociados a una mayor severidad.55 En ratones coinfectados con VIA y Staphylococcus aureus hay reclutamiento excesivo de neutrófilos a los pulmones y las NET, que contribuyen a la inflamación pulmonar severa.56 En forma similar, los pacientes con una infección severa por el VIA H1N1 y H7N9, tienen niveles elevados de las NET asociados con la severidad de la enfermedad y mal pronóstico.57
3.3 Tuberculosis: la OMS reportó 10.6 millones de nuevos casos de tuberculosis y 1.6 millones de muertes en 2021.58 M. tuberculosis causa tuberculosis (TB) y se transmite por aerosoles. Causa la infección asintomática (TB latente) en 90-95% y la TB activa en 5-10% de las personas infectadas, causando principalmente la TB pulmonar (TBP).58-61
La protección depende de la inmunidad innata y adquirida generada. Los neutrófilos participan en la respuesta hacia M. tuberculosis durante la infección temprana, llevando a cabo fagocitosis, producción de ROS, citocinas y quimiocinas.62 Sin embargo, aunque participan en la respuesta inmune son poco cruciales en la resolución de la enfermedad, probablemente porque son células de vida media corta.63 Participan en el reclutamiento de los macrófagos y favorecen la inflamación y la formación del granuloma para contener la infección.60,62-64
Contribuyen en la resistencia hacia la TB produciendo péptidos antimicrobianos (LL-37 y lipocalina 2) que participan en la eliminación de las micobacterias.65,66 Los macrófagos fagocitan las NET generados por la infección con M. tuberculosis y producen IL-1β, IL-6, TNF-α e IL-10 evidenciando su participación en la modulación de la respuesta inmune.67 Las NET están en el plasma de pacientes con TB y el aumento se correlaciona con la gravedad de la enfermedad.68,69
En la búsqueda de biomarcadores se ha encontrado aumentado el receptor FcγR1 (CD64) en los neutrófilos y monocitos de pacientes con TB activa, y puede ser un biomarcador predictivo de la enfermedad.59,70
3.4 Histoplasmosis pulmonar: causada por la inhalación de microconidios o fragmentos de micelo de Histoplasma capsulatum siendo una micosis endémica que afecta a más de 60 países.71 Con incidencia alta en América del Norte y en zonas tropicales de Latinoamérica con clima templado, subtropical o tropical húmedo.72
La enfermedad es benigna y asintomática en personas inmunocompetentes, pero puede evolucionar a una enfermedad pulmonar aguda, y la gravedad depende del estado inmunológico, el tiempo de exposición y la virulencia de la cepa.73 En los alvéolos pulmonares, los microconidios se convierten en levaduras y son fagocitados por los macrófagos a través del receptor CR3. Sin embargo, Histoplasma capsulatum se multiplica e induce la apoptosis para diseminarse a otras células.74 Los neutrófilos fagocitan a las levaduras opsonizadas a través de sus receptores CR1 y CR3, mientras que las no opsonizadas son reconocidas por el CD18 con la liberación de las NET.75 Los componentes de los gránulos azurófilos, como BPI y catepsina G inhiben el crecimiento de las levaduras.8,76
La protección depende de la inmunidad celular; sin embargo, la producción de IL-17A, promueve la granulopoyesis, producción y reclutamiento de los neutrófilos al sitio de infección.3,4,77 El estudio de fracciones subcelulares de neutrófilos ha demostrado que las levaduras favorecen la liberación de las NET y reducen su viabilidad.78
Estrategias terapéuticas en COVID-19
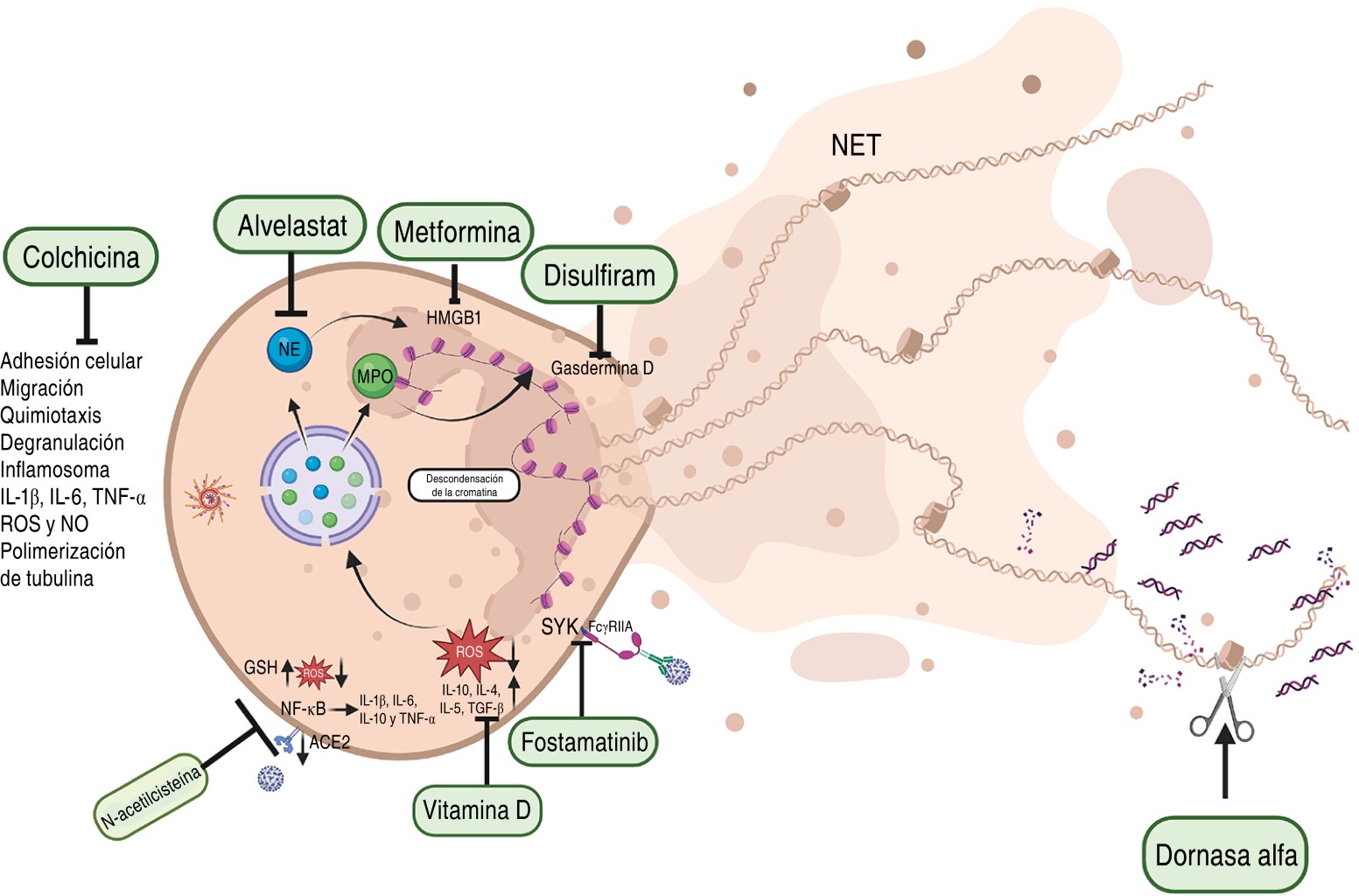
La mortalidad de los pacientes con COVID-19 (con ventilación mecánica) fue de 24-53%, en parte, debido a la interferencia de las secreciones mucopurulentas en la ventilación. Las NET de los neutrófilos contribuye a la viscosidad de las secreciones y, además, están presentes en el suero.
Existen casi 100 estudios clínicos que incluyen el uso de fármacos para inhibir la formación de NET aunque sólo 19 han sido concluidos.41 Los estudios han demostrado que el uso de la dornasa alfa en aerosol (Pulmozyme, DNAsa 1 recombinante humana y mucolítico) y albuterol disminuyen la viscosidad de las secreciones al degradar el ADN, mejorando la oxigenación y reduciendo el soporte respiratorio en los pacientes.79-82 Además, las complicaciones se deben a la presencia de los complejos antígeno-anticuerpo en el plasma, los cuales interaccionan con los receptores FcγRIIA (CD32a) en la membrana de los neutrófilos y favorecen la formación de las NET, pues bien, el fostamatinib es un fármaco que inhibe la vía de activación Spleen Tyrosine Kinase (SYK), asociada a estos receptores reduciendo la formación de las NET.83 También, hay estudios controlados en pacientes COVID-19 utilizando la colchicina, ya que interfiere en vías inflamatorias inhibiendo la adhesión, movilización, degranulación y quimiotaxis de los neutrófilos. Disminuye las moléculas de adhesión celular, en consecuencia, reduce la migración e interacción de los neutrófilos con las células endoteliales y su reclutamiento al sitio de inflamación. También, previene la polimerización de los microtúbulos inhibiendo la formación del NLRP3 inflamosoma reduciendo en la producción de IL-1ß que previene la producción de IL-6 y TNF-α, y también inhibe la producción de ROS y Nitric Oxide (NO).84,85
Adicionalmente, se han propuesto el uso de fármacos para bloquear los componentes de las NET como el alvelestat que inhibe a la NE involucrada en la inflamación,86 la metformina que se une a HMGB1 (High mobility group box 1) inhibiendo la inflamación,87 el disulfiram que se une a la gasdermina D inhibiendo su capacidad para causar poros en la membrana y promover la formación de las NET en pacientes COVID-19 reduciendo la inflamación y daño tisular.88
La producción de ROS es crítica ya que favorece la producción de las NET, y se han propuesto el uso de antioxidantes como N-acetilcisteína que tiene una función de antioxidante favoreciendo la producción del glutatión reducido que disminuye ROS; y un efecto antiinflamatorio al prevenir la unión del virus SARS-CoV-2 al receptor ACE2 e inhibe la activación del factor transcripcional NF-kB reduciendo la producción de las citocinas inflamatorias.89 Se ha propuesto el uso de la vitamina D porque tiene acciones antiinflamatorias al incrementar la producción de IL-10, IL-4, IL-5, y TGF- β, y porque a través de mecanismos antioxidantes reduce el estrés oxidativo y la producción de ROS (Figura 4).90
Conclusiones
Los neutrófilos son importantes en la defensa del hospedero; sin embargo, en las infecciones virales como es COVID-19 se asocia a eventos inflamatorios y trombosis. El conocimiento de sus mecanismos de acción ha permitido proponer alternativas terapéuticas que puedan brindar un mejor pronóstico a los pacientes con COVID-19. Mientras que en la tuberculosis e histoplasmosis tienen participación limitada en la resolución de enfermedad.
AFILIACIONES
1Facultad de Medicina, Universidad Nacional Autónoma de México, Ciudad de México 2Instituto Nacional de Enfermedades Respiratorias Ismael Cosío Villegas, Ciudad de México 3Universidad Autónoma del Estado de Hidalgo, México. 4Ambos autores contribuyeron por igual en la escritura del artículo.Conflicto de intereses: los autores declaran no tener conflicto de intereses.
REFERENCIAS
Jacobo-Delgado YM, Torres-Juarez F, Rodríguez-Carlos A, Santos-Mena A, Enciso-Moreno JE, Rivas-Santiago C, et al. Retinoic acid induces antimicrobial peptides and cytokines leading to Mycobacterium tuberculosis elimination in airway epithelial cells. Peptides. 2021;142: 170580. Available from: https://pubmed.ncbi.nlm.nih.gov/34033876/
Pitangui N de S, Sardi J de CO, Voltan AR, dos Santos CT, da Silva J de F, da Silva RAM, et al. An intracellular arrangement of Histoplasma capsulatum yeast-aggregates generates nuclear damage to the cultured murine alveolar macrophages. Front Microbiol. 2016;6:1526. Available from: https://pubmed.ncbi.nlm.nih.gov/26793172/