Introducción
El soporte de vida extracorpóreo (ECLS, Extra Corporeal Life Support) engloba un conjunto de dispositivos capaces de asistir de manera mecánica las funciones cardiaca y pulmonar de manera temporal y prolongada1. De entre ellas, la terapia de oxigenación por membrana extracorpórea (ECMO, Extracorporeal Membrane Oxygenation) surgió como una opción de soporte inicialmente respiratorio en la década de 1970, pero en la actualidad este dispositivo mecánico tiene la competencia de asistir a pacientes tanto con insufi-ciencia respiratoria como con insuficiencia circulatoria aguda refractarias a manejo convencional óptimo. Al iniciar la terapia ECMO se puede modificar el manejo médico que propicia mayor daño al paciente, como reducir las dosis altas de vasopresores e inotrópicos o modificar con seguridad los parámetros de ventilación mecánica y así mantener las metas de protección pulmonar2,3. El manejo en general de los pacientes en ECMO difiere profundamente del cuidado convencional de los pacientes críticos; se requiere un entendimiento profundo de la fisiología y la fisiopatología cardio-pulmonares, así como de la fisiología de la ECMO, para lograr un punto adecuado de equilibrio entre aporte y consumo de oxígeno, y mantener la perfusión orgánica para así lograr la recuperación deseada. El propósito de la presente revisión es describir estos principios básicos para el entendimiento de la terapia ECMO, y asimismo presentar el análisis gasométrico como una herramienta de monitoreo hemodinámico que proporciona variables vinculadas al gasto cardiaco (GC), la microcirculación, la oxigenación y el metabolismo, además de ayudar a distinguir proporcionalmente el aporte de oxígeno de la asistencia circulatoria y el del propio paciente, per-mitiendo tener una adecuada evaluación de la perfusión de los tejidos.
Fisiología y fisiopatología cardiopulmonar
El pilar del funcionamiento metabólico adecuado es el oxígeno, que al unirse con algunos sustratos producirá energía y calor, liberando metabolitos como el dióxido de carbono (CO2) y agua. Por lo tanto, la relación del metabolismo general con el consumo de oxígeno (VO2) es estrecha; la tasa de consumo de oxígeno de un adulto en reposo es de 120 ml/min/m2 (en niños, 4-5 ml/kg/min)4 (Fig. 1). El requerimiento metabólico puede aumentar o disminuir según la situación clínica del paciente; la fiebre, algunos fármacos y hormonas incrementan el consumo de oxígeno, y situaciones como hipotermia, sedación y parálisis lo disminuyen5. Cuando la tasa metabólica incrementa, el requerimiento de oxígeno también, y en este caso lo ideal es que la disponibilidad de oxígeno aumente. El oxígeno en la sangre viaja unido a la hemoglobina (Hb) y disuelto en el plasma. Se puede calcular el contenido arterial de oxígeno (CaO2) por medio del análisis de gases sanguíneos de la siguiente manera:

Figura 1. A: representación de la entrega de oxígeno (DO2) y el consumo de oxígeno (VO2). B: valores de referencia. CaO2: contenido arterial de oxígeno; CvO2: contenido venoso de oxígeno; GC: gasto cardiaco; SaO2: saturación arterial de oxígeno; SvO2: saturación venosa de oxígeno.
Cada gramo de Hb completamente saturada trans-porta 1.34 ml de oxígeno. Además, el oxígeno disuelto en plasma puede estimarse considerando que por cada mmHg de presión parcial de oxígeno (PaO2) se disuelven 0.0031 ml de oxígeno por decilitro de sangre. No obstante, esta fracción aporta una cantidad mínima, por lo que suele obviarse en el cálculo del CaO2.
De estas variables, la de mayor importancia es la Hb, que trasporta el 99% del oxígeno al organismo; por ello, también se puede calcular el contenido de oxígeno venoso (CvO2) con una gasometría venosa central o mixta. El oxígeno total que llega a los tejidos se denomina aporte de oxígeno (DO2) y se calcula multiplicando el CaO2 por el GC6. El DO2 en sujetos sanos suele ser 4-5 veces mayor que el VO2, pero en pacientes críticos la relación se altera sustancialmente; se ha identificado como punto crítico para un meta-bolismo anaerobio la relación DO2:VO2 de 2:1, y por ende, en los pacientes críticos se recomienda mantener el DO2 al menos 3 veces en relación con el VO27.
En un evento agudo, el organismo no es capaz de incrementar la Hb o la oxigenación, y por lo tanto el principal determinante del DO2 es el GC, el cual incrementará para compensar la alteración de la relación DO2:VO2 dada por una caída inicial de DO2 o un incremento del VO2. Esto será tolerado hasta llegar al punto crítico mostrado en la figura 2, en el cual se acentuará el metabolismo anaerobio, conllevando mayor producción de lactato y otros metabolitos, y si esto persiste se desarrollarán acidosis, lesión celular irreversible y falla orgánica múltiple8.
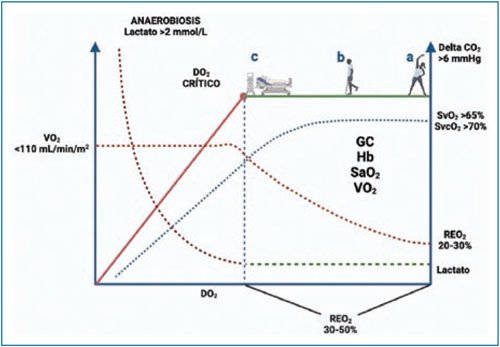
Figura 2. Esquematización de la relación entre la entrega de oxígeno y el consumo de oxígeno (DO2:VO2). En el supuesto de que la alteración es en la DO2, la zona verde representa el punto óptimo de la relación DO2:VO2, siendo la persona a un individuo sano con adecuado equilibrio. La persona b presenta una reducción de la DO2, que puede ser por alguna alteración crónica como insuficiencia cardiaca, neumopatía o anemia, con una relación DO2:VO2 más estrecha, pero sin hipoperfusión. La persona c es un individuo enfermo con una condición aguda que altera su relación DO2:VO2, y en caso de no recibir el manejo adecuado progresará al punto rojo, conocido como punto crítico, con una zona inclinada, donde el VO2 se vuelve dependiente de la DO2 y se establece la etapa de débito de oxígeno; si en este punto no se interviene, se producirán lesión celular y falla multiorgánica. La línea azul punteada muestra el comportamiento de la saturación venosa de oxígeno (SvO2) con reducción cuando la relación DO2:VO2 se estrecha, correlacionándose con un incremento en la tasa de extracción de oxígeno (REO2). La línea punteada verde muestra cómo el lactato tendrá un incremento abrupto a partir del punto crítico. En la flecha superior se indica cómo el delta de CO2 aumentará cuando la DO2 disminuye secundario a un gasto cardiaco (GC) bajo.
En cuanto al VO2, se sabe que el consumo o la producción de una sustancia en un tejido se puede calcular al conocer la concentración de esa sustancia previo al ingreso al tejido, la concentración posterior al paso del tejido y la velocidad de paso de la sustancia (flujo sanguíneo), por lo que se puede calcular el VO2 global al conocer el GC, el oxígeno sanguíneo posterior a la oxigenación pulmonar (CaO2) y el oxígeno previo a la misma (CvO2), mediante muestras arterial y venosa central o mixta, respectivamente, calculándose de la siguiente manera9:
Hay que destacar que el VO2 no solo depende de las necesidades metabólicas del paciente, y nunca podrá ser mayor que el DO2, por lo que cuando este cae de manera excesiva el VO2 se vuelve dependiente de él, como se muestra en la línea roja continua de la figura 2, donde la relación es lineal; clínicamente, el paciente necesita un mayor VO2, pero no se puede llevar a cabo. Este débito de oxígeno propicia la lesión mitocondrial irreversible, con posterior apoptosis o necrosis10.
El CO2 es un metabolito de la degradación de hidratos de carbono; específicamente, se libera en el ciclo de Krebs, y en la sangre viaja disuelto en el plasma, unido a proteínas sanguíneas (carbaminos) y en forma de bicarbonato. Su concentración sanguínea depende esencialmente de su tasa de producción y de su tasa de eliminación; se puede presentar un discreto incremento en su concentración sanguínea durante la fiebre, el aumento del catabolismo y la sobrealimentación, esto por incremento en su producción11. La eliminación depende tanto de la ventilación alveolar como del flujo sanguíneo; sin este último, no se puede transportar al alveolo para su exhalación. Bajo este concepto, una elevación de CO2 puede ser por hipoventilación o por bajo flujo sanguíneo, y una disminución por hiperventilación o por alto flujo sanguíneo. El análisis gasométrico del CO2 es útil para inferir el GC si se descartan otras causas de su alteración, siendo la más relevante la ventilatoria; por ese motivo, se analiza con dos gasometrías, arterial y venosa central. Si la causa es ventilatoria, el CO2 venoso y arterial se modificarán proporcionalmente, sin tener una diferencia mayor de 6 mmHg (diferencia arteriovenosa de CO2 [DavCO2]), y si la diferencia es mayor de 6 mmHg indica bajo flujo sanguíneo (macro- o microcirculatorio) y se correlaciona bien con el GC en estados de choque, ya sea car-diogénico o hipovolémico12.
La tasa de extracción de oxígeno (REO2) es el porcentaje de oxígeno que se consume por los tejidos del total transportado, sabiendo que el DO2 óptimo debe ser 4-5 veces mayor que el consumo, y entonces la extracción adecuada debe rondar el 20-25%, teniendo en cuenta que la caída del DO2 o el incremento del VO2 propician el aumento de la REO2 (un 50% será igual a una relación DO2/VO2 de 1:2). Esto se puede calcular con cualquiera de las siguientes fórmulas:
Este es el principio por el cual la saturación venosa central es ampliamente utilizada como marcador de la REO2 y de la relación DO2/VO2. Mientras que las variables que influyen en la disociación del oxígeno con la Hb no estén alteradas y la SO2 por pulsioxímetro se encuentre en el 94-97%, la fórmula 100 – SvO2 es confiable para determinar la DO2/VO213,14.
Estrategias terapéuticas
Cuando se detecte un desajuste de la relación DO2/VO2 por cualquiera de los métodos previos, hay que corregirlo lo más pronto posible para evitar llegar a una lesión irreversible. Cuando el DO2 se encuentra bajo puede ser por caída cualquiera de sus determinates (GC, Hb u oxemia); si la oxemia y la Hb se encuentran en rangos normales (SaO2 94-97% y Hb 7-9 g/dl), entonces se tomarán medidas para mejorar el GC por medio de la infusión de volumen, inotrópicos o disminución de la poscarga, dependiendo del contexto clínico. Cuando el VO2 es excesivo suele ser por fiebre, esfuerzo respiratorio importante, convulsiones o dolor, y entonces se deberán proporcionar antipiréticos, ajustar la ventilación mecánica, en caso necesario usar sedación y relajantes neuromusculares, anticonvulsivos, etc.
Fisiología en la ECMO
En estados de choque o insuficiencia respiratoria, la relación DO2:VO2 puede ser cercana a 2:1 o inferior; en este momento es cuando el inicio de la terapia con ECLS es crucial. El ECLS mantiene la relación DO2:VO2 cercana al estado fisiológico, lo que permite que los órganos que son insuficientes sean tratados, logren una recuperación o puedan ser trasplantados15. El circuito de ECMO está compuesto por las cánulas de extracción y retorno, las tuberías, una bomba (generalmente centrífuga) y el oxigenador (pulmón artificial). Durante la asistencia con ECMO, la sangre venosa es drenada de la aurícula derecha a través de una cánula conectada a un sistema de tuberías (3/8 en adulto), constituyendo tres circuitos principales: prebomba, premembrana y posmembrana. En el circuito prebomba, la presión es negativa idealmente (no menos de –60 mmHg, también conocida como presión venosa negativa o P1), se bombea mediante un pulmón artificial (oxigenador) pasando por el circuito premembrana, donde la presión se vuelve positiva (P2), y se devuelve a la aorta (ECMO-VA, venoarterial) o a la aurícula derecha (ECMO-VV, venovenosa) mediante el circuito posmembrana, donde la presión del circuito continúa siendo positiva, pero no mayor de 300 mmHg (P3).
El flujo de sangre a través de estos circuitos de cánulas puede estar limitado principalmente por el tamaño de la cánula de drenaje venoso. La resistencia al flujo será menor cuanto mayor sea el diámetro interno y menor sea la longitud del catéter, lo que permitirá una mayor tasa de flujo extracorpóreo.
De una forma más simple, la ECMO mantiene la relación DO2:VO2 drenando la mayoría de la sangre venosa. En la configuración de ECMO-VA, el flujo de sangre es bombeado a través del oxigenador y de regreso a la circulación sistémica, evitando su paso por el corazón y los pulmones, donde el órgano artificial (membrana oxigenadora) mantiene la función cardiaca. En los pacientes con insuficiencia respiratoria a los que se configura asistencia con ECMO-VV, el flujo de sangre es drenado del oxigenador a la aurícula derecha, lo que permite que la sangre previamente oxigenada sea transportada mediante la circulación pulmonar y posterior a la circulación sistémica. La figura 3 muestra los componentes de la ECMO, sus diferentes circuitos en un escenario de ECMO-VA y la configuración de ECMO-VV para el manejo en la insuficiencia respiratoria).
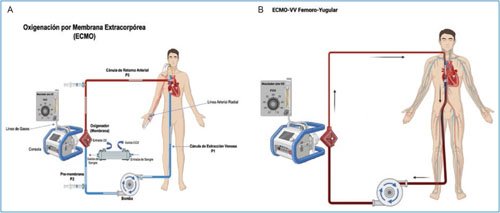
Figura 3. Representación gráfica de las configuraciones de ECMO convencionales venoarterial (ECMO-VA) y venovenosa (ECMO-VV). A: se observa en azul el flujo de extracción que procede de la cánula venosa colocada en la unión cavo-atrial y llega a la bomba (centrífuga) para posteriormente pasar al oxigenador o membrana (circuito premembrana). El flujo sanguíneo, tras pasar por la membrana (la cual aporta oxígeno y elimina CO2), sale de la membrana y retorna por el circuito posmembrana a la aorta a través de una cánula arterial. El mezclador de gases regula el nivel de fracción inspiratoria de oxígeno y el flujo de gases frescos. Se muestran los sitios de toma de muestras para monitoreo gasométrico (premembrana, posmembrana y arterial periférica). B: configuración de ECMO-VV femoro-yugular, con cánula de extracción en la vena femoral derecha y retorno del flujo de sangre a la vena yugular interna derecha.
En la ECMO, el oxígeno difunde en la membrana a través de miles de pequeños tubos o fibras huecas que permiten la difusión de gases, pero no de líquidos, a través de sus paredes hacia la sangre venosa, incrementando la SaO2 desde condiciones venosas con saturación del 75% hasta una saturación del 100%. Esta oxigenación de la sangre está controlada por el área de superficie de difusión de la membrana, la saturación venosa, el tiempo de contacto en la membrana, la cantidad total de Hb y el flujo sanguíneo16 (Fig. 4).
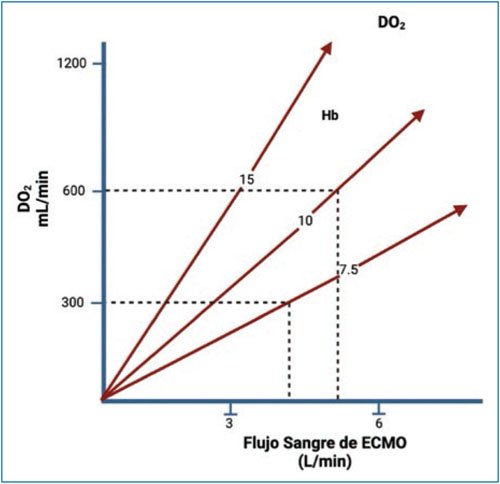
Figura 4. Gráfico que muestra que, al ser el gasto cardiaco (GC) el principal determinante de la entrega de oxígeno (DO2), y al ser el GC total del paciente el flujo de sangre del ECMO más el retorno venoso nativo, al aumentar el flujo de ECMO existirá un aumento progresivo de la DO2. La cantidad de oxígeno suministrado por unidad de flujo depende de la cantidad de hemoglobina (Hb) en la sangre (modificado de McLaren et al.18).
Otro suceso importante durante la terapia extracorpórea es la depuración de CO2 como en el pulmón normal, que se ajusta mediante el flujo de gas de ventilación. Este suele adaptarse al mismo ritmo que el flujo de sangre al inicio de la asistencia (posteriormente se ajusta con las muestras de gases arteriales). La tasa de transferencia de CO2 por el oxigenador es muy eficaz (a pesar de poseer un gradiente de difusión menor que el oxígeno, ya que tiene un coeficiente de difusión 20 veces mayor que este), y en general se requieren flujos bajos de gas para su eliminación. El aumento del flujo de gas no tiene efecto sobre la oxigenación. La cantidad de CO2 depurada por cualquier membrana es el contenido de CO2 de entrada menos el contenido de CO2 de salida. Así, si la relación entre el flujo de gas y el flujo de sangre es 1:1 igual al del oxígeno, o si se incrementa la relación hasta 8:1, se logra una mayor diferencia y remoción de CO22,15,16.
Monitoreo hemodinámico en la ECMO con gasometría
El principio básico del uso de ECMO como asistencia circulatoria en su modalidad básica ECMO-VA es otorgar un flujo sanguíneo sustituto del GC nativo del paciente, ya que este es inadecuado para mantener una adecuada perfusión orgánica. Con esta premisa partimos para considerar entonces que el DO2 será calculado a partir del flujo sanguíneo otorgado por la ECMO más el GC nativo del paciente. La configuración más común de esta modalidad es en la periférica femoro-femoral, con una cánula de extracción venosa, con la punta ubicada en la unión cavo-atrial, y una cánula de retorno arterial, en la aorta descendente. La cánula de extracción que se dirige a la unión cavo-atrial, al extraer la sangre, evita que todo el flujo sanguíneo que retorna a la aurícula derecha pase en su totalidad por las cavidades derechas y la circulación pulmonar; como resultado, la medición de gases a este nivel (antes de su paso por la membrana oxigenadora) da información sobre la oxigenación sanguínea después de perfundir los tejidos, de tal manera que se puede considerar igual a tomar una muestra de sangre venosa central y con esta calcular el consumo de oxígeno a partir del CvO2. Además del cálculo del contenido de oxígeno premembrana (CvO2), para el análisis hemodinámico por gasometría se deben calcular los contenidos de oxígeno posmembrana (CpO2) y del paciente (CaO2) en muestras tomadas en los puntos mostrados en la figura 3A. En cuanto al GC global o funcional, este va a tener dos componentes: el flujo otorgado por la ECMO y el GC nativo. El primero no requerirá un cálculo, pues el flujómetro del equipo reporta exactamente la cantidad otorgada, y respecto al segundo, siempre existe un GC nativo pese a la falla ventricular presente, aunque sea mínimo, pues si no fuera así, la válvula aórtica permanecería cerrada ocasionando una trombosis intracavitaria. Para el cálculo de este GC no serán precisos equipos con termodilución convencional o transpulmonar, ya que la cánula de extracción y de retorno afectará el cambio de temperatura del líquido administrado para su medición. Las técnicas de análisis de contorno de la onda de pulso por línea arterial tampoco son válidas, por la pérdida de pulsatilidad debido tanto a falla ventricular como al flujo sanguíneo continuo aportado por la ECMO.
Una manera de calcular el GC total o efectivo mediante el taller gasométrico es usando la siguiente fórmula:
Sin embargo, el cálculo por este método también es impreciso, ya que depende de la ecuación de Fick modificada, en la cual se utiliza un VO2 estimado. Se recomienda para el cálculo del GC nativo utilizar el método ecocardiográfico: mediante una aproxima-ción paraesternal, ubicada entre el segundo y el cuarto espacio intercostales con la marca del transductor orientada hacia el hombro derecho, se ubica el tracto de salida del ventrículo izquierdo (TSVI) y se mide el diámetro unos 5 mm a 1 cm antes de la válvula aortica (VAo), se calcula el área del TSVI con la formula A = πr2 y después, a través de una aproximación api-cal, en una vista de cinco cámaras (quinto espacio intercostal intersectando con la línea media clavicular/línea axilar anterior, con la marca de transductor a las 3 de las manecillas de reloj y con una inclinación que muestre el TSVI y la VAo, se mide mediante Doppler pulsado justo 5 mm a 1 cm antes de la válvula, obteniéndose así el flujo en el TSVI. Se trazará con el lápiz electrónico el contorno de este flujo y se obtendrá la integral velocidad-tiempo, cuyo resultado se multi-plicará por el área del TSVI calculada antes, obteniendo el volumen sistólico, que al multiplicarse por la frecuen-cia cardiaca nos dará el GC nativo17. Con los resultados del GC nativo, el flujo de sangre otorgado por la ECMO y los contenidos de oxígeno comentados se desarrollan las fórmulas del taller hemodinámico:
– GC total (gasometrías): flujo ECMO × (CpO2 – CvO2/CaO2 – CvO2).
– GC total: flujo ECMO + GC nativo (calculado por ecocardiografía).
– Aporte de oxígeno (DO2): CaO2 × (GC total) × 10 (se multiplica por 10 para transformar litros en decilitros). Valor normal aproximado 1000 ml/min; indexado 520 a 570 ml/min/m2.
– Consumo de oxígeno (VO2): (CaO2 – CvO2) × (GC total) × 10. Valor normal aproximado 200 ml/min; indexado 110 a 160 ml/min/m2.
– Relación DO2/VO2 (deseada en ECMO mayor de 3:1).
– Aporte de oxígeno de la membrana: CpO2 – CvO2. Valor normal 3-5 ml/dl; es un indicador de que el oxigenador funciona adecuadamente.
– REO2: – (DO2/VO2) × 100, – (CaO2-CvO2/CaO2) × 100, – (SaO2-SvO2/SaO2) × 100.
– Retorno venoso nativo (RVN): en un paciente teóricamente sin cortocircuitos importantes, el retorno venoso y el GC son iguales, por lo que el RVN es igual al GC nativo calculado por ultrasonido. Si se calculó el GC con la fórmula gasométrica, entonces el RVN se calculará como: flujo (Q) total – flujo ECMO. Este resultado es relevante sobre todo en pacientes que están requiriendo soporte respiratorio, ya que si el RVN es mayor que el flujo de la cánula de extracción puede ocasionar hipoxemia (mayor cantidad de sangre pasa por los pulmones enfermos); normalmente es de 1.5 a 2 l/min.
Casos clínicos
Caso clínico 1
Varón de 30 años, con peso de 79 kg y talla de 170 cm, área de superficie corporal 1.9 m2, con diagnó-stico de síndrome de dificultad respiratoria aguda por neumonía, en asistencia con ECMO-VV femoro-yugular, en su quinto día de asistencia. En la tabla 1 se muestran los valores del taller gasométrico y hemodinámico.
Tabla 1. Parámetros hemodinámicos y de taller gasométrico de un paciente en ECMO-VV
| Hb: 8.9 g/dl | CpO2 (posmembrana): 12.75 ml/dl |
| SaO2: 95% | DAVO2: 2.86 ml/dl |
| PaO2: 78 mmHg | REO2: 25.5% |
| SvO2 (premembrana): 69% | GC (gasometrías): 6.16 l/min |
| PvO2: 40 mmHg | DO2: 689 ml/min |
| SaO2 (posmembrana): 100% | Índice de aporte de oxígeno (IDO2): 362.8 ml/min/m2 |
| PaO2 (posmembrana): 277 mmHg | VO2: 176.17 ml/min |
| Flujo de ECMO: 4 l/min | Índice de aporte de oxígeno (IVO2): 92.6 ml/min/m2 |
| Lactato: 1.8 mmol/l | Relación DO2:VO2: 3.9:1 |
| GC por ecocardiografía: 4.8 l/min | Transferencia de oxígeno (membrana): 4.41 ml/dl |
| CaO2: 11.2 ml/dl | Retorno venoso nativo: 2.16 l/min |
| CvO2 (premembrana): 8.34 ml/dl |
El paciente está adecuadamente asistido, tiene una SvO2 adecuada, lactato < 2 mmol/l, diferencia de oxígeno (DAVO2) normal y relación DO2:VO2 > 3:1. A pesar de que el aporte es bajo en este paciente, es adecuado, ya que la relación DO2:VO2 se mantiene, y no hay datos de mala perfusión ni anaerobiosis. Al estar con sedación, relajación neuromuscular y ventilación mecánica, su VO2 se mantiene bajo. Es probable que al iniciar la progresión del paciente (suspensión de la relajación y disminución de la sedación), al despertar y asistir sus ventilaciones aumente su VO2, por lo que en dicha situación el DO2 podría no ser adecuado, por lo que para mantener la relación DO2:VO2 tal vez sería necesario aumentar el flujo de sangre de la ECMO o transfundir al paciente.
Caso clínico 2
Varón de 49 años, con peso de 62 kg y talla de 164 cm, área de superficie corporal 1.67 m2, en posoperatorio de cirugía de Bentall-De Bono, que desarrolló choque cardiogénico poscardiotomía, asistido con ECMO-VA periférica femoro-femoral, actualmente en su segundo día de asistencia. En la tabla 2 se muestran los datos de la evaluación gasométrica.
Tabla 2. Parámetros hemodinámicos y de taller gasométrico de un paciente en ECMO-VA
| Hb: 9.3 g/dl | CvO2 (premembrana): 7.83 ml/dl |
| SaO2: 99% | CpO2 (posmembrana): 13.43 ml/dl |
| PaO2: 201 mmHg (línea radial derecha) | DaVO2: 5.13 ml/dl |
| SvO2 (premembrana): 62% | REO2: 39.7% |
| PvO2: 33 mmHg | DO2: 557.28 ml/min |
| SaO2 (posmembrana): 100% | IDO2: 333.1 ml/min/m2 |
| PaO2 (posmembrana): 312 mmHg | VO2: 220.59 ml/min |
| Flujo de ECMO: 2.9 l/min | IVO2: 131.8 ml/min/m2 |
| Lactato: 3.2 mmol/l | Relación DO2:VO2: 2.5:1 |
| GC por ecocardiografía: 1.4 l/min | Transferencia de oxígeno (membrana): 6.08 ml/dl |
| GC por Swan-Ganz: 1.6 l/min | Retorno venoso nativo: 1.4 l/min |
| CaO2: 12.96 ml/dl |
El paciente está infraasistido, con DO2 bajo y una relación DO2/VO2 < 3:1. Además, presenta una SvO2 disminuida, DavO2 y REO2 aumentadas, y lactato > 2 mmol/l. Se debería aumentar el DO2 mediante un aumento del flujo de ECMO o transfundir al paciente, y tras estas intervenciones reevaluar con un nuevo taller. El paciente aún no muestra datos de recuperación cardiaca, ya que su GC nativo es bajo (tanto por ecocardiografía como por Swan-Ganz), además de que la PaO2 arterial se encuentra muy alta (> 200 mmHg), lo cual sugiere que la mezcla en el pulmón nativo es escasa, correlacionando con el GC nativo disminuido.
Conclusiones
El ECLS, especialmente la ECMO, se ha consolidado como una herramienta vital en el manejo de pacientes con insuficiencia respiratoria y circulatoria aguda. Esta tecnología permite asistir mecánicamente las fun-ciones cardiaca y pulmonar, reduciendo la necesidad de tratamientos invasivos adicionales y protegiendo los pulmones durante la recuperación. El análisis gaso-mé-trico es de suma importancia para la monitorización y el ajuste de la terapia ECMO, proporcionando información esencial sobre el equilibrio entre el aporte y el consumo de oxígeno. La medición precisa del contenido de oxígeno (CaO2, CvO2, CpO2) y del GC permite una evaluación efectiva del estado hemodinámico del paciente y guía las intervenciones terapéuticas. En los casos clínicos revisados se observó que una adecuada relación DO2/VO2 y un monitoreo continuo permiten ajustar el soporte de ECMO de manera efectiva. El primer paciente mostró un equilibrio adecuado, mientras que el segundo paciente requirió ajustes en el flujo de ECMO debido a un insuficiente aporte de oxígeno y una baja relación DO2/VO2. El análisis gasométrico es relevante en la optimización del manejo de pacientes críticos en ECMO, garantizando un soporte adecuado y mejorando las posibilidades de recuperación.
Financiamiento
El presente trabajo no recibió patrocinios.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses.
Consideraciones éticas
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad, consentimiento informado y aprobación ética. El estudio no involucra datos personales de pacientes ni requiere aprobación ética. No se aplican las guías SAGER.
Declaración sobre el uso de inteligencia artificial. Los autores declaran que no utilizaron ningún tipo de inteligencia artificial generativa para la redacción de este manuscrito.